
| A. | 新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-) | |
| B. | pH=8的NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1HCl溶液与0.2 mol•L-1 NH3•H2O溶液等体积混合pH>7:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 0.1mol•L-1K2C2O4溶液与0.2 mol•L-1KHC2O4溶液等体积混合:4c(K+)=3[c(C2O42-)+c(HC2O4-)] |
分析 A.电荷守恒式为c(H+)=c(ClO-)+c(Cl-)+c(OH-),物料守恒为c(Cl-)=c(ClO-)+c(HClO),据此计算分析判断;
B.pH=8的NaClO2溶液中ClO2-离子水解溶液显碱性;
C.0.1mol•L-1HCl溶液与0.2 mol•L-1 NH3•H2O溶液等体积混合得到等浓度的 NH3•H2O和NH4Cl的混合溶液,溶液pH>7,说明一水合氨电离大于铵根离子的水解;
D.0.1mol•L-1K2C2O4溶液与0.2 mol•L-1KHC2O4溶液等体积混合溶液中存在物料守恒,4n(C2O4)=3n(K).
解答 解:A.电荷守恒式为c(H+)=c(ClO-)+c(Cl-)+c(OH-),物料守恒为c(Cl-)=c(ClO-)+c(HClO),则c(H+)=c(HClO)+2c(ClO-)+c(OH-),故A正确;
B.pH=8的NaClO2溶液中ClO2-离子水解溶液显碱性,离子浓度大小为:c(Na+)>c(ClO2-)>c(OH-)>c(H+),故B正确;
C.0.1mol•L-1HCl溶液与0.2 mol•L-1 NH3•H2O溶液等体积混合得到等浓度的 NH3•H2O和NH4Cl的混合溶液,溶液pH>7,说明一水合氨电离大于铵根离子的水解,c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故C错误;
D.0.1mol•L-1K2C2O4溶液与0.2 mol•L-1KHC2O4溶液等体积混合溶液中存在物料守恒,4n(C2O4)=3n(K),3c(K+)=4[c(C2O42-)+c(HC2O4-)+c(H2C2O4)],故D错误;
故选AB.
点评 本题考查了电解质溶液中离子浓度大小比较、电解质溶液中电荷守恒、物料守恒等知识点,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
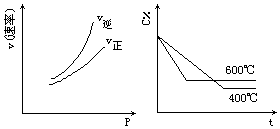 都符合图中两个图象的反应是:(C%表示某反应物的百分含量,v表示反应速率,p表示压强,t表示时间)( )
都符合图中两个图象的反应是:(C%表示某反应物的百分含量,v表示反应速率,p表示压强,t表示时间)( )| A. | N2O3(g)?NO2(g)+NO(g)-Q | B. | 3NO2(g)+H2O(l)?2HNO3 (aq)+NO(g)+Q | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+Q | D. | CO2(g)+C(s)?2CO(g)-Q |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
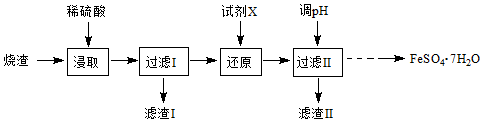
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应的△H>0,吸热反应的△H<0 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸密封保存 | |
| B. | 氢氟酸保存在玻璃瓶中 | |
| C. | 新制氯水保存在棕色试剂瓶中 | |
| D. | 烧碱溶液可用带橡皮塞的玻璃瓶暂时保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>X | |
| C. | 最简单氢化物的稳定性:W<Z<X | |
| D. | Y的氧化物不属于两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 废旧电池必须回收,主要目的是回收其中的金属 | |
| B. | “从沙滩到用户”,计算机芯片的材料是指单质硅 | |
| C. | 利用风能,太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | “光化学烟雾”,“硝酸型酸雨”的形成都与氮氧化物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
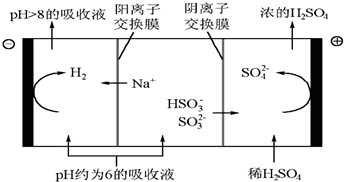
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com