
| A. | ①②⑤ | B. | ③④⑤⑦ | C. | ②④⑥ | D. | ③⑤⑥⑦ |
分析 ①氦气所处的状态不明确;
②求出17g羟基的物质的量,然后根据1mol羟基中含9mol电子来分析;
③铁发生氧化还原反应后可能变为+3价,还可能变为+2价;
④甲酸为弱电解质,能部分电离;
⑤标准状况下,甲醇为液体;
⑥常温常压,气体摩尔体积小于22.4L/mol;
⑦一个氢氧化铝胶粒是多个氢氧化铝的聚集体.
解答 解:①氦气所处的状态不明确,故不能计算其物质的量和和含有的电子数,故错误;
②17g羟基的物质的量为1ol,而1mol羟基中含8mol中子,故含8NA个,故正确;
③铁发生氧化还原反应后可能变为+3价,还可能变为+2价,故56g铁即1mol铁反应失去的电子数可能为3NA个,还可能为2NA个,故错误;
④甲酸为弱电解质,能部分电离,故溶液中的甲酸分子个数小于0.05NA个,故正确;
⑤标准状况下,甲醇为液体,故不能根据气体摩尔体积来计算其物质的量和含有的H原子个数,故错误;
⑥常温常压,气体摩尔体积小于22.4L/mol,硅22.4LNO的物质的量小于1mol,则分子个数小于NA个,故正确;
⑦一个氢氧化铝胶粒是多个氢氧化铝的聚集体,故1mol铝离子水解得到的氢氧化铝胶粒的个数小于NA个,故错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 交警检查司机是否酒后驾车的原理中体现了乙醇的氧化性 | |
| B. | 硅胶多孔,吸附水分能力强,常用作袋装食品、瓶装药品的干燥剂 | |
| C. | 铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: | B. | Cl-的结构示意图: | ||
| C. | 中子数为21的钾原子:${\;}_{19}^{40}$K | D. | 对硝基苯酚的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| B. | 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
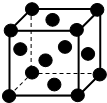 经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )| A. | 该晶体与氯化钠的晶体类型相同 | |
| B. | 该晶体熔化只需要破坏共价键 | |
| C. | SiH4分子的稳定性强于甲烷 | |
| D. | 每个顶点的甲烷与之距离最近的甲烷分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com