
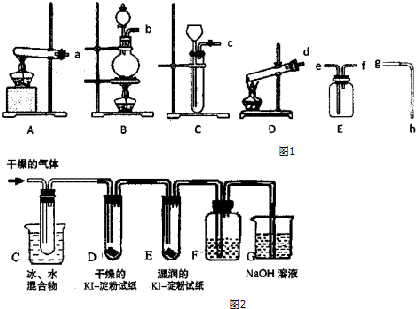
分析 Ⅰ.实验室可用MnO2和KClO3混合加热的方法制取氧气:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$3O2↑+2KCl,反应是固体+固体$\stackrel{△}{→}$气体,选择在大试管中加热反应,选择装置A,氧气是不溶于水的比空气重的气体,收集气体排水法收集氧气的操作,仪器连接为a-f-e-g-h通过广口瓶中排水收集气体,
(1)依据反应物状态和反应条件选择气体发生装置,反应是固体+固体$\stackrel{△}{→}$气体,选择大试管加热生成;
(2)氧气是难溶于水的比空气重的气体,用排水法收集导气管短进长出;
Ⅱ.KClO3分解时尚有副反应,导致收集到的气体有异味.据推测,副产物可能是O3、Cl2、ClO2中的一种或几种.资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2.为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入如图2装置进行实验,通过冰水混合气体,ClO2的沸点高0°C冷凝下来,通过装置D中干燥的KI-淀粉试纸无现象,通过装置E中湿润的KI-淀粉试纸,变蓝色,若要确认副产物中含Cl2,F中应盛放硝酸银溶液,最后剩余气体不能排放到空气中需要通入氢氧化钠溶液中吸收,
(3)确认副产物中含Cl2,利用氯气和水反应生成盐酸和次氯酸,加入硝酸银溶液生成白色沉淀证明含有氯气;
(4)ClO2的沸点11℃,冷却变化为液态,确定副产物中含有ClO2的现象是装置C中有液体生成;
(5)实验时若D中无现象,E中试纸变蓝,说明气体中含有氧化性的气体,O3、氯气都具有强氧化性;
Ⅲ.(6)依据化学方程式计算ClO2反应生成ClO2-,原水样中的ClO2-和ClO2反应生成ClO2-,调节PH和碘离子反应,依据反应ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后产生b mol I2.计算得到ClO2-,物质的量共为0.5bmol,减去第一个反应生成的ClO2-,得到原水样中含有的ClO2-,得到饮用水中ClO2-的浓度;
解答 解:Ⅰ.(1)用作KClO3为原料制氧气,选择固体加热装置,上述装置只有A符合,B为固体与液体反应,C没有加热,D中试管口没向下倾斜,故答案为:A;
(2)排水法收集氧气,则选择装满水的试剂瓶和导管、烧杯等,进入盛满水的试剂瓶应短进长出,则仪器连接顺序为氧气出口→f→e→g→h→烧杯,
故答案为:f;e.
Ⅱ.(3)利用氯气和水反应生成盐酸和次氯酸,加入硝酸银溶液生成白色沉淀证明含有氯气,若要确认副产物中含Cl2,F中应盛放硝酸银溶液;
故答案为:AgNO3溶液;
(4)ClO2的沸点11℃,冷却会变化为液态,所以确定副产物中含有ClO2的现象是C装置试管中有液体生成;
故答案为:C装置试管中有液体生成;
(5)实验时若D中无现象,E中试纸变蓝,说明气体中含有氧化性的气体,O3、氯气都具有强氧化性,所以上述现象不能说明副产物含有O3的结论,氯气也可以银行碘化钾生成碘单质;
故答案为:不能,Cl2也可以氧化KI产生I2;
Ⅲ.(6)准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2;原水样中的ClO2-和ClO2反应生成ClO2-,调节PH后,ClO2-和碘离子反应,依据反应ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后产生b mol I2.计算得到ClO2-,物质的量共为0.5bmol,减去第一个反应生成的ClO2-物质的量,依据化学方程式2ClO2+2I-═I2+2ClO2-,计算得到为2amol,得到原水样中含有的ClO2-物质的量=(0.5b-2a)mol,得到饮用水中ClO2-的浓度=$\frac{(0.5b-2a)mol}{V×1{0}^{-3}L}$=$\frac{1000(0.5b-2a)}{V}$mol/L;
故答案为:$\frac{1000(0.5b-2a)}{V}$;
点评 本题考查了气体制备实验过程和装置分析判断,反应过程中的现象和题干信息利用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- | |
| D. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x值为1 | B. | 混合气体的密度增大 | ||
| C. | 平衡时N的浓度为 0.6 mol/L | D. | N的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为0.6mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为0.6mol•L-1•s-1 | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的物质的量为 1.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.068 MPa-1 | B. | 0.082 | C. | 0.072 MPa-1 | D. | 0.082 MPa-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C=O | C═O | C-H |
| E/(kJ•mol-1) | 436 | 803 | 1070 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 饱和硫酸镁溶液 | C. | 饱和氯化钡溶液 | D. | 饱和硫酸铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
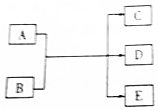 一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体. ,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com