
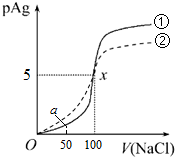
| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | Kφ(AgCl)=1×10-10 | |
| C. | a点时,溶液中c(Cl-)=1.2×10-9mol•L-1 | |
| D. | 若把0.1mol•L-1的NaCl溶液换成0.1mol•L-1的NaI溶液,则pAg的变化图象变成曲线② |
分析 A、根据pAg=-lg{c(Ag+)}求出Ag+的浓度;
B、据pAg=5时各离子浓度计算;
C、首先计算消耗的n(Ag+),然后算出反应后溶液中的c(Ag+),进而通过溶度积常数计算氯离子浓度;
D、由于Ksp(AgI)更小,所以a点时溶液中c(I-)会比c(Cl-)小,据此解答.
解答 解:A、图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100mol•L-1,即原AgNO3溶液的物质的量浓度为1 mol•L-1,故A正确;
B、当加入V(NaCl)=100mL时,n(Ag+)=n(Cl-),AgNO3和NaCl恰好完全反应生成AgCl沉淀,根据图示信息pAg=5时,c(Ag+)=1.0×10-5mol•L-1,所以Kφ(AgCl)=1.0×10-5mol•L-1×1.0×10-5mol•L-1=1.0×10-10mol2•L-2,故B正确;
C、当加入50mL NaCl溶液后,消耗的n(Ag+)=0.05L×0.1mol•L-1=0.005mol,反应后溶液中的c(Ag+)=$\frac{0.01L×1mol/L-0.005mol}{0.06L}$=$\frac{1}{12}$mol/L,则c(Cl-)=$\frac{{K}_{sp}(AgCl)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-10}}{\frac{1}{12}}mol/L$=1.2×10-9mol•L-1,故C正确;
D、与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol•L-1的NaCl换成0.1mol•L-1NaI,则a点时溶液中c(I-)会比c(Cl-)小,即②线应该在①线的下方,图象不符,故D错误.
故选D.
点评 本题考查了AgCl的Ksp的应用,注意把握题干中的信息,考查学生分析题目信息并用于解决问题的能力,题目难度中等.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na原子简化的核外电子排布式:[Na]3s1 | |
| B. | Cr原子的价电子排布式:3d54s1 | |
| C. | NH4Cl的电子式: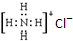 | |
| D. | Fe原子的结构示意图: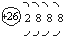 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
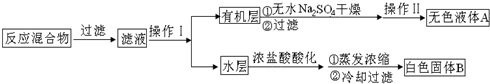
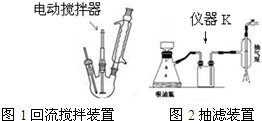
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加水稀释至10 L | B. | 加入一定量的NaOH固体 | ||
| C. | 加入一定量pH=8的NaOH溶液 | D. | 加入一定浓度的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2溶液:c(SO42-)>(K+)=c(Al3+ )>c(H+)>c(OH-) | |
| B. | NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | Na2S溶液:c(OH-)-(H+)=c(HS-)+c(H2S) | |
| D. | CH3COONa与 HCl混合后呈中性的溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | |||
| M | X | Z |
| A. | 钠与Z可能形成只含离子键的Na2Z、Na2Z2化合物 | |
| B. | X的最高价氧化物不与任何酸反应 | |
| C. | Y的最简单气态氢化物的热稳定性比X的强,因为Y的最简单气态氢化物分子间存在氢键 | |
| D. | M的简单离子半径是同周期中简单离子半径最小的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com