
分析 (1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)先根据n=cV计算500ml 0.2mol/L CuSO4溶液中CuSO4的物质的量,根据m=nM计算溶质的质量;
(3)烧杯、玻璃棒上粘有溶质,需洗涤并转移到容量瓶中;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)所配溶液的体积为500ml,应用500ml容量瓶配制,将用天平称出的固体加入到烧杯中溶解,冷却后用玻璃棒引流转移到500ml容量瓶中,并用适量水洗涤烧杯和玻璃棒2~3次,把洗涤液也移入容量瓶中,后面用胶头滴管来定容,
故答案为:500mL容量瓶、胶头滴管;
(2)用CuSO4•5H2O配制500mL0.2mol•L-1CuSO4溶液,需要CuSO4•5H2O质量为:m(CuSO4)=0.5L×0.2mol/L×250g/mol=25.0g,
故答案为:25.0;
(3)没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,为保证溶质全部转移到容量瓶中,需用适量水洗涤烧杯和玻璃棒2~3次,把洗涤液也移入容量瓶中,并摇匀,
故答案为:烧杯;玻璃棒;
(4)A.称量NaOH固体时,放在烧杯中且称量较慢会导致NaOH潮解,实际的NaOH固体的质量偏小,则浓度偏低;
B.称量NaOH固体时,砝码与药品位置颠倒时m物=m砝-m游,但由于没用游码,故对所称量的药品的质量无影响,对所配溶液的浓度无影响;
C.溶解搅拌时,溶液溅到烧杯外面会导致溶质损失,溶液浓度偏低;
D.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响;
E.移液时,忘记洗涤烧杯内壁,会导致溶质损失,溶液浓度偏低;
F.定容时,俯视刻度线,会导致溶液体积偏小,浓度偏高.
故所配浓度偏高的是F,偏低的是ACE,无影响的是BD.
故答案为:F;ACE;BD.
点评 本题考查了配制一定物质的量浓度的溶液,主要考查了实验步骤和仪器的使用等知识,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 从碘水中提取碘的方法是萃取 | |
| B. | 物质的量浓度的单位是mol/L | |
| C. | 胶体与溶液的本质区别是丁达尔效应 | |
| D. | 氧化还原反应的实质是电子的转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
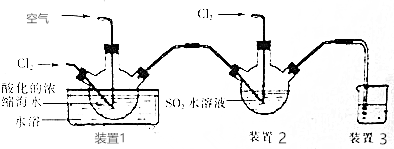
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | Ⅱ中的现象 | 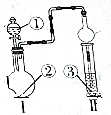 |
| A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色最终变为浅红色 | |
| B | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先产生白色沉淀,后沉淀溶解 | |
| C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
| D | 浓硝酸 | 铜 | 硅酸钠溶液 | 有胶状物生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积 V(mL) |
| 1 | 22.4 | 10.00 |
| 2 | 22.60 | 10.00 |
| 3 | 26.00 | 10.00 |
| 4 | 22.50 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | 6 | 7 | ||||||
| 3 | 1 | 3 | 5 | 8 | 10 | |||
| 4 | 2 | 4 | 9 |
 H++Cl-+HClO.
H++Cl-+HClO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com