
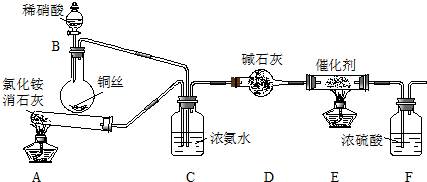

���� ��1�����ڼ��������£��Ȼ�狀��������Ʒ�Ӧ�����Ȼ��ơ�������ˮ��
��װ��C�е�Ũ��ˮ����ʹ������Ȼ�ϣ����Կ����������٣�
��װ��F�е�Ũ��������δ��Ӧ�İ�����
��2���ٵ�NOx��Na2CO3��Һ��ȫ����ʱ����n��NO2����n��NO����
�����ü������غ㷨���������
�����ò���������NO��NO2�����ʵ������ٸ���ƽ��Ħ������������xֵ��
��3�����������ж����Ի�������Ⱦ��
��� �⣺��1�����ڼ��������£��Ȼ�狀��������Ʒ�Ӧ�����Ȼ��ơ�������ˮ��2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
�ʴ�Ϊ��2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
��װ��C�е�Ũ��ˮ����ʹ������Ȼ�ϣ����Կ����������٣�װ��C��������ʹNH3��NO��Ͼ��Ȳ������������٣�
�ʴ�Ϊ��ʹNH3��NO��Ͼ��Ȳ������������٣�
��װ��F�е�Ũ��������δ��Ӧ�İ�������ֹ����İ����ŷŵ���������Ⱦ������
�ʴ�Ϊ������ĩ��Ӧ��NH3��ֹ��Ⱦ������
��2���ٵ�NOx��Na2CO3��Һ��ȫ����ʱ����n��NO2����n��NO������n��NO2����n��NO��=1ʱxֵ��С��x��СֵΪ$\frac{2+1}{2}$=1.5����Ϊ����NO������x���ֵ��2����x��ȡֵ��ΧΪ1.5��x��2������x��ֵ��������1.3��
�ʴ�Ϊ��A��
���ü�������x=1.5����ӦΪNO��NO2�������ʵ�����Ϊ1��1������ʽ��Ӧ��û��NO3-����aӦ�ñ�ʾNO2-��
���غ㷨����Ӧ���ɵ�NaNO3��NaNO2�е�Ԫ������Ԫ��֮��Ϊ1��1������1mol NOx����ȫ����������̼����0.5mol������Ϊ53g�������̼������Һ������Ϊ250g��
�ʴ�Ϊ��NO2-��250��
������NO2�ʹ��Ӧ����CO2Ϊamol��
��NO��NO2�봿�Ӧ������CO2Ϊbmol��
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ��������
1mol��m=48g
amol 48ag
NO+NO2+Na2CO3=2NaNO2+CO2 ��������
1mol��m=32g
bmol 32bg
a+b=1
48a+32b=44
���a=0.75mol
b=0.25mol
n��NO2��=0.75mol��2+0.25mol=1.75mol
n��NO��=0.25mol
x=$\frac{0.25mol��1+1.75mol��2}{0.25mol+1.75mol}$=1.875��
�ʴ�Ϊ��1.875��
��3�����������ж����Ի�������Ⱦ���ô������յ��������ܽ��ж�����ת��Ϊ�����ʣ���ֹ�ж��������Ⱦ��
�ʴ�Ϊ�����ж�����ת��Ϊ�����ʣ���ֹ�ж��������Ⱦ��
���� �����Ե�������Ϊ���忼�������ʼ�ķ�Ӧ����ȷ���ʵ������ǽⱾ��ؼ����ѵ��ǣ�2����ļ��㣬Ҫ��Ϸ���ʽ�и���������֮��Ĺ�ϵʽ��𣬻���������Ϣ����xֵ���Ѷ��еȣ�


 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��˵��NH3���H+������H2Oǿ��NH3+H3O+=NH4++H2O | |
| B�� | ��˵��������H2O2��Fe3+��2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C�� | ��˵��������ǿ�HCl+AgNO3=AgCl��+HNO3 | |
| D�� | ��˵��CH3COOH��������ʣ�CH3COO-+H2O?CH3COOH+OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4��Ħ��������98g | |
| B�� | 1molO2��������32g | |
| C�� | ����Ħ������������ԭ�ӵ����ԭ������ | |
| D�� | 1molNa+��������23g/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ�� ��� | ̼��� ״̬ | c��HCl�� /mol•L-1 | ��Һ�¶�/�� | ̼�����ʧ ʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||
| 1 | ��״ | 0.5 | 20 | 39 | 400 |
| 2 | ��ĩ | 0.5 | 20 | 40 | 60 |
| 3 | ��״ | 0.6 | 20 | 41 | 280 |
| 4 | ��״ | 0.8 | 20 | 40 | 200 |
| 5 | ��ĩ | 0.8 | 20 | 40 | 30 |
| 6 | ��״ | 1.0 | 20 | 40 | 120 |
| 7 | ��״ | 1.0 | 30 | 50 | 40 |
| 8 | ��״ | 1.2 | 20 | 40 | 90 |
| 9 | ��״ | 1.2 | 25 | 45 | 40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �����������壨FeC2O4•2H2O���ʵ���ɫ��ij������Ϊ̽��������������Ļ�ѧ���ʣ�������һϵ��ʵ��̽����
�����������壨FeC2O4•2H2O���ʵ���ɫ��ij������Ϊ̽��������������Ļ�ѧ���ʣ�������һϵ��ʵ��̽����| ʵ�鲽�裨��Ҫ��д������������̣� | Ԥ��ʵ������ͽ��� |
| ȡ������ɫ���壬��������ϡ�����ϡ���ᣬ����Һ�м������軯����Һ | ��Һ�����ɫ�������һ��������Һ��ɺ�ɫ�������һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +3 | B�� | +4 | C�� | +6 | D�� | +7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
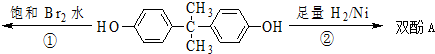
| A�� | ˫��A�ķ���ʽ��C15H16O2 | |
| B�� | ˫��A�ĺ˴Ź���������ʾ��ԭ����֮����1��2��2��3 | |
| C�� | ��Ӧ���У�1 mol˫��A�������4mol Br2 | |
| D�� | ��Ӧ�ڵIJ����������ֹ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ʊ��屽ʱ����������ˮ��ϣ������� | |
| B�� | ��ȥ�����л��еĶ�����̼ʱ������ͨ���ռ���Һ��Ũ���� | |
| C�� | �����Ը��������Һ�еμӼ��α����������Ϻ�ɫ��ȥ | |
| D�� | �ڱ���ͭ�����Ʊ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com