
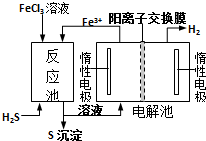
 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中正确的是( )| A. | 电解池中OH-从右槽迁移到左槽 | |
| B. | H+在右槽发生氧化反应 | |
| C. | 左槽中发生的反应是:4OH--4e-═O2↑+2H2O | |
| D. | 常温常压下,反应中每转移1mol电子生成1g氢气 |
分析 FeCl3溶液氧化H2S发生反应:2FeCl3+H2S=2FeCl2+2HCl+S↓,反应池中溶液移入电解池左槽,而电解池左槽产生Fe3+,右槽生成氢气,因此左槽为阳极、右槽为阴极,由于还原性Fe2+>Cl-,左槽中Fe2+放电生成Fe3+,右槽中氢离子放电生成氢气,质子通过质子交换膜移向阴极.
解答 解:通过图示可知Fe2+在电解池的左槽中转化为Fe3+,H+在右槽转化为H2,因此左槽为阳极右槽为阴极.
A.电解过程中阳离子向阴极移动,阴离子向阳极移动,即电解池中OH-左槽,但是中间选用阳离子交换膜,OH-无法通过,故A错误;
B.右槽为阴极,因此电极反应式为:2H++2e-=H2↑或2H2O=H2↑+2OH-,H+在右槽发生还原反应,故B错误;
C.左槽为阳极,由于还原性Fe2+>Cl-,因此电极反应式为:Fe2+-e-=Fe3+,故C错误;
D.右槽为阴极,电极反应式为:2H++2e-=H2↑,每转移1mol电子生成0.5mol即1g氢气,故D正确,
故选:D.
点评 本题考查电解工作原理,电解本质是氧化还原反应,理解电极反应与离子的放电顺序是关键,难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 若A、B均能发生消去反应,则C一定能发生消去反应 | |
| B. | 若 A、B分子中分别含有1个、2个碳原子,则C的摩尔质量不小于60g.mol-1 | |
| C. | 若A是乙醇,则B可能是丙三醇 | |
| D. | 若A、B均存在醇类同分异构体,则 C一定存在醇类同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3溶液 | B. | NaCl溶液 | C. | 铜粉 | D. | 硫酸铜晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
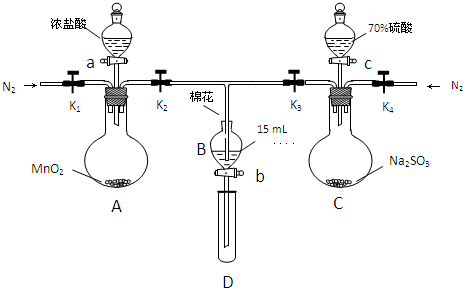
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
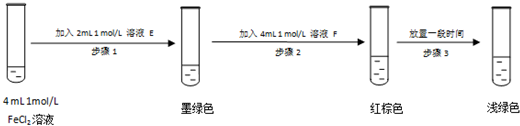
 Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
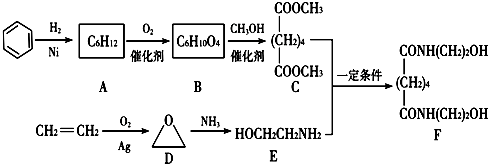
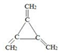 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅和二氧化碳在物理性质上有很大的差别 | |
| B. | 二氧化硅分子由一个硅原子和两个氧原子构成 | |
| C. | 工业上用二氧化硅制粗硅 | |
| D. | 二氧化硅既能与氢氟酸反应,又能与烧碱反应,但它不是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com