
【题目】某厂废水中含5.00×10-3mol·L-1的Cr2O72- , 其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: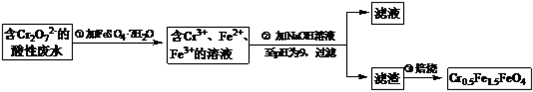
(1)第①步反应的离子方程式是;
(2)第②步中用pH试纸测定溶液pH的操作是:;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有;
(4)欲使1L该废水中Cr2O72-的完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O。
【答案】
(1)Cr2O72-+6Fe2++14H+=2Cr3+ +6Fe3++7H2O
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(3)Fe(OH)3、Fe(OH)2
(4)13.9 g
【解析】(1)Cr2O72-有较强氧化性,FeSO47H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+ , 自身被还原为Cr3+ , 根据守恒元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O,所以答案是:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上;所以答案是:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(3)由题给框图可得:Fe2+过量,加NaOH时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,所以答案是:Fe(OH)3、Fe(OH)2;
(4)1 L废水中含n(Cr2O72-)=5.00×10-3 mol。根据Cr原子、Fe原子守恒,可得:Cr2O72-~~~4Cr0.5Fe1.5FeO4~~~10FeSO47H2O,所以理论上n(FeSO47H2O)=10n(Cr2O72-)=5.00×10-3mol×10=0.05mol,所以m(FeSO47H2O)=0.05 mol×278 g/mol=13.9 g,所以答案是:13.9g。


科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.100molL﹣1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) 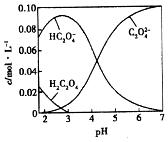
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42﹣)>c(HC2O4﹣)
B.c(Na+)=0.100 molL﹣1的溶液中:c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣)
C.c(HC2O4﹣)=c(C2O42﹣)的溶液中:c(Na+)>0.100 molL﹣1+c(HC2O4﹣)
D.pH=7.0的溶液中:c(Na+)=2(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )
A.20℃20mL 3mol/L的X溶液
B.20℃10mL 4mol/L的X溶液
C.20℃30mL 2mol/L的X溶液
D.10℃20mL 4mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NaHSO4溶于水只需要克服离子键
B. 单质分子中都存在化学键
C. 晶体熔沸点由高到低的顺序为:金刚石>碳化硅>氯化钠
D. 干冰气化,克服了共价键和分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图1和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验. 
下列说法正确的是( )
A.H2O2中只含有极性共价键,不含离子键
B.2NO2N2O4的平衡常数K随温度升高而减小
C.向H2O2中加入Fe2(SO4)3后,B中颜色变浅
D.H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值. Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离. ①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验. ①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 .
(4)Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 . 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在古代与现代的科技发展中起了十分重要的作用,下列说法中正确的是( )
|
|
|
|
古代与现代的冶金均运用了相同的化学原理 | 古代与现代的火箭发射均利用了液体燃料 | 古代捣碎中药与现代中药纳米粉碎均是化学变化 | 古代风筝与现代热气球飞行均无需物质直接供给能量 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业品盐酸中因含有Fe3+而带黄色,若某工业品盐酸中的H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为:
A.1:1B.1:3C.91:94 D.1:94
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com