
| A. | 反应的还原产物是N2 | |
| B. | 消耗1 mol氧化剂,转移电子3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
分析 c(NH4+)随反应进行逐渐减小,NH4+应是反应物,N元素化合价发生变化,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题.
解答 解:反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,
A.反应中N元素化合价升高,被氧化,则N2为氧化产物,故A错误;
B.Cl元素的化合价由+1价降低为-1,消耗1mol氧化剂剂,转移电子6mol,故B错误;
C.由反应可知,氧化剂与还原剂的物质的量之比为3:2,故C错误;
D.反应生成H+,溶液酸性增强,故D正确.
故选D.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | NO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | NO2 | NH3 | MgCl2 |
| ④ | NO2 | O2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A. | ①②③ | B. | ①④⑤ | C. | ①②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
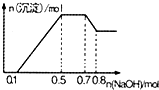 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 无法确定溶液中是否含有CO32-、SO42-和Cl- | |
| C. | 溶液中n(NH4+)=0.2mol | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
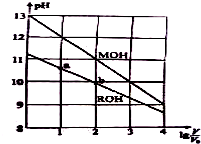 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg $\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg $\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | MOH 的电离程度随lg $\frac{V}{{V}_{0}}$的增大而增大 | |
| B. | ROH 的电离程度:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)相等 | |
| D. | 当lg $\frac{V}{{V}_{0}}$=2 时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气在生产、生活和科研中应用十分广泛
氨气在生产、生活和科研中应用十分广泛查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从反应开始到建立平衡所需时间:tA>tB | |
| B. | 平衡时I2的浓度:c(I2)A=c(I2)B | |
| C. | 平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器 | |
| D. | 平衡时HI的分解率:aA=aB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若M(甲)>M(乙),则分子数:甲>乙 | B. | 若M(甲)<M(乙),则气体摩尔体积:甲>乙 | ||
| C. | 若M(甲)<M(乙),则气体的压强:甲>乙 | D. | 若M(甲)>M(乙),则气体体积:甲<乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+NaOH═NaCl+H2O | B. | SO3+H2O═H2SO4 | ||
| C. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
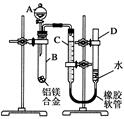 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com