
【题目】据外媒报道,WirthResearch公司公布了其用轻型氢燃料电池作为主要能源的无人空中系统(UAS)的设计,该轻型氢燃料电池比普通理离子电池具有更高的能量密度(能量密度是指单位体积或重量可以存储的能量多少)。用吸附了H2的碳纳米管等材料制作的二次电池的原理如下图所示。该电池的总反应为H2+2NiO(OH) ![]() 2Ni(OH)2,已知:6NiO(OH)+NH3+H2O+OH-=6Ni(OH)2+NO2-。下列说法不正确的是
2Ni(OH)2,已知:6NiO(OH)+NH3+H2O+OH-=6Ni(OH)2+NO2-。下列说法不正确的是
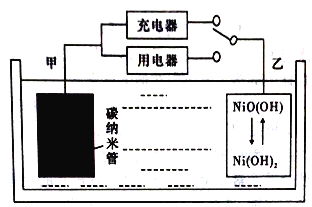
A. 碳纳米管吸附H2的密度越大,电池的能量密度越高
B. 电池可以用KOH溶液、氨水等作为电解质溶液
C. 放电时.乙电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
D. 充电时,电池的碳电极与直流电源的负极相连
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.已知CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表:下列叙述正确的是( )
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.该反应达到平衡后,保持容器体积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C.830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻υ正<υ逆
D.830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( ) 
A.1 mol X在一定条件下最多与8 mol H2加成
B.1 mol X在一定条件下最多能与2 mol NaOH反应
C.X中有二种含氧官能团,酸性条件下水解产物中也有二种含氧官能团
D.X分子式为C16H12O4 , 和乙醇发生反应生成分子式为C18H18O5的酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ①③ B. ②④⑤
C. ①④⑤ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示, K值大小与温度的关系是:温度升高,K值 。(填一定增大、一定减小、或可能增大也可能减小)。
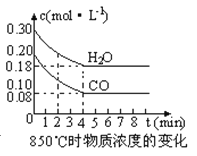
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g) ![]() CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c 1数值 0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 (单选),表中5min~6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃有两种或两种以上的同分异构体,其某一种同分异构体的一氯代物只有一种,则这种烃可能是( ) ①分子中含有7个碳原子的芳香烃 ②分子中含有4个碳原子的烷烃
③分子中含有12个氢原子的烷烃 ④分子中含有8个碳原子的烷烃.
A.③④
B.②③
C.①②
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 常温下电离常数为Ka的酸HA的溶液中c(H+)=![]() mol/L
mol/L
C. 常温下同浓度的强酸和强碱溶液等体积混合后,由水电离出的c(H+)=10-7mol/L
D. 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7、Ka2=4.7×10-11,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾羅的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=-4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_____________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
向一定条件下的恒容密用容器中充入NO和CO,用传感器测得该反应在不同时间时NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(NO)=V(CO)
②此条件下达到平衡时,该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下, NaHSO3显___性 (填“酸”“碱”或“中”,判断的理由是(通过计算说明)______。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。
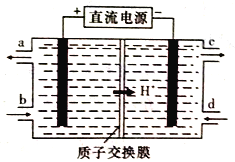
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同条件下进行合成氨的反应,根据下列在相同时间内测定的结果判断生成氨的速率最快的是( )
A.v(H2)=0.1 mol/(Lmin)
B.v(N2)=0.1 mol/(Lmin)
C.v(N2)=0.2 mol/(Lmin)
D.v(NH3)=0.3 mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com