
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
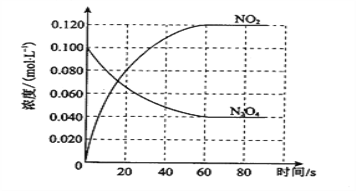
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为_____________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。T______100 ℃(填“大于”或“小于”),判断理由是____________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是____________________________________。
【答案】 大于 0.0010 0.36 mol·L-1 大于 反应正方向吸热,反应向吸热方向进行,故温度升高 逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
【解析】(1)温度升高,混合气体的颜色变深,说明平衡向正反应方向进行,因此正反应是吸热反应,则反应的ΔH大于0;在0~60 s时段内消耗四氧化二氮的物质的量浓度为0.1mol/L-0.040mol/L=0.06mol/L,因此反应速率v(N2O4)=0.06mol/L÷60s=0.0010mol·L-1·s-1;平衡时N2O4、NO2的浓度分别是0.04mol/L、0.12mol/L,则反应的平衡常数K1为![]() 。(2)c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,说明平衡向正反应方向进行,由于正反应吸热,所以改变的条件是升高温度,即T大于100 ℃;(3)由于正反应体积增大,所以对气体分子数增大的反应,增大压强平衡向逆反应方向移动。
。(2)c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,说明平衡向正反应方向进行,由于正反应吸热,所以改变的条件是升高温度,即T大于100 ℃;(3)由于正反应体积增大,所以对气体分子数增大的反应,增大压强平衡向逆反应方向移动。


科目:高中化学 来源: 题型:
【题目】下列各选项中,可用右侧示意图表示的是

反应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量氨,在同一容器中:2NH3 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量的钾、钠分别与水反应 | H2的质量 | 钠 | 钾 |
C | 体积比为1︰3的N2、H2,在体积可变的恒压容器中: N2+3H2 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2mol SO2与1mol O2,在相同温度下:2SO2+O2 | SO3的物质的量 | 10 MPa | 20 MPa |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 浓硝酸与碳反应会产生红棕色气体
B. 试管内壁上附着的硫可用二硫化碳洗去
C. 工业上利用N2与H2反应进行氮的固定
D. 实验室用加热NH4Cl晶体的方法制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示. 
(1)为提高锌灰的浸取率,可采用的方法是(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为
③已知Na2SO4 . 10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL,物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)一种高效氯化剂、漂白剂,在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠.
(1)ClO2中氯元素的化合价是;在制备亚氯酸钠的反应中ClO2做(填“氧化剂”或“还原剂”);若反应中生成1molNaClO2 , 转移电子物质的量为mol;
(2)写出该反应的化学方程式为;
(3)科学家经研究发现NaClO2也可用于制取自来水消毒剂ClO2 . 2NaClO2+Cl2═2ClO2+2NaCl,还原产物为 , 用单线桥法标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
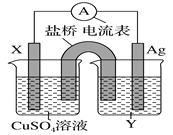
(1)电极X的材料是______;电解质溶液Y是________。
(2)银电极为电池的______极,发生的电极反应式为_______________;X电极上发生的电极反应式为_________________。
(3)下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。则电极a为电解池的_______极,b电极附近出现的现象为______________。
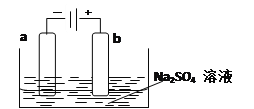
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO45H2O,实现废物综合利用.他们进行了两组实验,过程如下: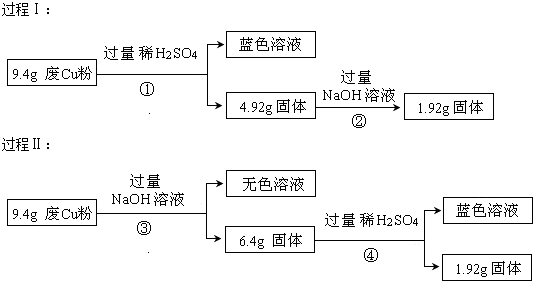
(1)废Cu粉中一定含有的杂质是(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:①;
③;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)= , m(Cu)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表有____个横行,叫周期,每一周期中元素原子的_________相同,从左到右元素的金属性____(填增强或减弱);元素周期表中有_____列,第ⅥA族处在第_____列,同一主族从上到下,元素的非金属性依次_______(填增强或减弱)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com