
| A. | +2 | B. | +4 | C. | 0 | D. | +6 |
分析 该反应中XO(OH)2+和Na2SO3 发生氧化还原反应,Na2SO3被氧化为Na2SO4,则X元素得电子化合价降低,再结合转移电子守恒计算还原产物中X化合价.
解答 解:该反应中XO(OH)2+和Na2SO3 发生氧化还原反应,Na2SO3被氧化为Na2SO4,S元素的化合价由+4价升高为+6价,则X的化合价降低,设元素X在还原产物中的化合价为x,
由电子守恒可知,0.2mol/L×0.03L×(6-4)=2.4mol×(5-x),
解得x=0,
故选:C.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,明确氧化还原反应中元素的化合价升降及电子守恒是解答本题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
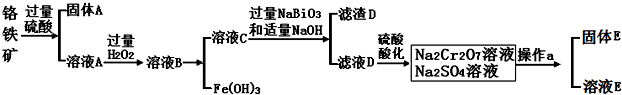
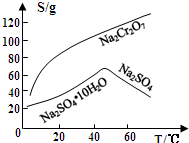

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与硝酸反应:Fe3O4+8H+ ═Fe2++2Fe3++4H2O | 书写正确 |
| B | 工业制粗硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | 错误,生成物应是Si和CO |
| C | NaAlO2溶液与少量CO2反应: AlO2- ̄+CO2+2H2O═HCO3- ̄+Al(OH)3↓ | 书写正确 |
| D | NaHCO3溶液中加入少量石灰水:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O | 错误,生成物 中不含CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
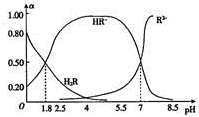 室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )| A. | H2R的一级电离平衡常数Kal≈0.25 | |
| B. | pH=2.5的H2R溶液中:c(HR-)+2c(R2-)+c(OH-)=l0-2.5 | |
| C. | pH=5.5的该溶液中:c(HR一)>c(R2一)>c(H+)>c(OH一) | |
| D. | 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 4个Cl-和2个NH3分子均与Pt4+配位 | |
| D. | 配合物中4个Cl-与Pt4+配位,而2个NH3分子与Pt4+不配位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
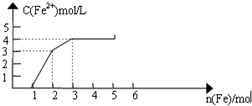 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )| A. | 1:8 | B. | 1:9 | C. | 3:8 | D. | 1:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
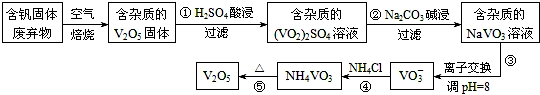
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
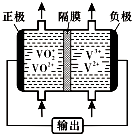
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com