
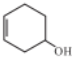
 )能发生多种不同反应;回答下列问题:
)能发生多种不同反应;回答下列问题: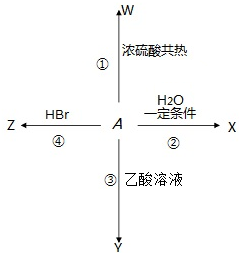
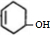 ,分子式为C6H10O,A与水发生加成反应生成X,A中碳碳双键不是对称结构,故生成X有2种结构,X的结构简式为
,分子式为C6H10O,A与水发生加成反应生成X,A中碳碳双键不是对称结构,故生成X有2种结构,X的结构简式为 ,只含有羟基.A中碳碳双键与HBr发生加成、羟基与HBr可以发生取代反应,故Z的结构简式为
,只含有羟基.A中碳碳双键与HBr发生加成、羟基与HBr可以发生取代反应,故Z的结构简式为 或
或 等,A在浓硫酸、加热条件下,可能发生消去反应生成
等,A在浓硫酸、加热条件下,可能发生消去反应生成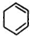 等,也可能发生分子间脱水生成
等,也可能发生分子间脱水生成 ,A与乙酸发生酯化反应生成Y为
,A与乙酸发生酯化反应生成Y为 ,据此解答.
,据此解答. ,A与水发生加成反应生成X,A中碳碳双键不是对称结构,故生成X有2种结构,X的结构简式为
,A与水发生加成反应生成X,A中碳碳双键不是对称结构,故生成X有2种结构,X的结构简式为 ,只含有羟基.A中碳碳双键与HBr发生加成、羟基与HBr可以发生取代反应,故Z的结构简式为
,只含有羟基.A中碳碳双键与HBr发生加成、羟基与HBr可以发生取代反应,故Z的结构简式为 或
或 等,A在浓硫酸、加热条件下,可能发生消去反应生成
等,A在浓硫酸、加热条件下,可能发生消去反应生成 等,也可能发生分子间脱水生成
等,也可能发生分子间脱水生成 ,A与乙酸发生酯化反应生成Y为
,A与乙酸发生酯化反应生成Y为 ,
, ,分子式为C6H10O,故答案为:C6H10O;
,分子式为C6H10O,故答案为:C6H10O; ,不是纯净物,故答案为:②;否;
,不是纯净物,故答案为:②;否; ,故答案为:
,故答案为: ;
; 、
、 等,故答案为:
等,故答案为: 、
、 等;
等; ,酯基与氢氧化钠反应,1mol Y(
,酯基与氢氧化钠反应,1mol Y( )完全反应需消耗1mol NaOH,故答案为:1;
)完全反应需消耗1mol NaOH,故答案为:1;

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,543.4g |
| C、950mL,572g |
| D、500mL,286g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、目前使用的燃料液化石油气,其主要成分均属于烃 |
| B、油脂、纤维素、蛋白质都是高分子化合物 |
| C、石油裂解、煤的气化、海水制镁都包含化学变化 |
| D、食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
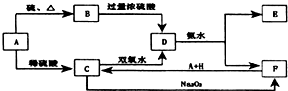 中学化学中几种常见物质的转化关系如图所示:
中学化学中几种常见物质的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2?2NH3△H<0.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2?2NH3△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Cl2对自来水进行消毒杀菌 |
| B、用SO2漂白食品 |
| C、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
| D、用小苏打(NaHCO3)发酵面团制作馒头 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com