

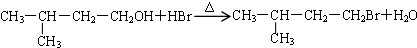 ;
; ;
;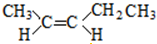 和
和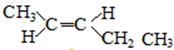 .
. 分析 B可在NaOH乙醇溶液加热的条件下反应生成A,则A中含有C=C,有机物A为烃类化合物,质谱图表明其相对分子质量为70,根据$\frac{70}{14}$=5,则A的分子式为C5H10,B的分子式为C5H11Br,D能与银氨溶液反应,说明D中含有-CHO,E中含有-COOH,B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰,说明含有4种不同的H原子,D应为 CH3-CH(CH3)-CH2-CHO,E应为 CH3-CH(CH3)-CH2-COOH,C为 CH3-CH(CH3)-CH2-CH2OH,B为CH3-CH(CH3)-CH2-CH2Br,则A为CH3-CH(CH3)-CH=CH2,结合有机物的结构和性质解答该题.
解答 解:B可在NaOH乙醇溶液加热的条件下反应生成A,则A中含有C=C,有机物A为烃类化合物,质谱图表明其相对分子质量为70,根据$\frac{70}{14}$=5,则A的分子式为C5H10,B的分子式为C5H11Br,D能与银氨溶液反应,说明D中含有-CHO,E中含有-COOH,B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰,说明含有4种不同的H原子,D应为 CH3-CH(CH3)-CH2-CHO,E应为 CH3-CH(CH3)-CH2-COOH,C为 CH3-CH(CH3)-CH2-CH2OH,B为CH3-CH(CH3)-CH2-CH2Br,则A为CH3-CH(CH3)-CH=CH2,
(1)由以上分析可知D为CH3-CH(CH3)-CH2-CHO,分子式为C5H10O,
故答案为:C5H10O;
(2)B为CH3-CH(CH3)-CH2-CH2Br,含有的官能团为溴原子,
故答案为:溴原子;
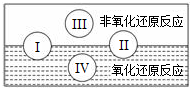
(3)反应Ⅲ为加成反应,与氢气加成反应生成醇,也为还原反应,故答案为:a、b;
(4)反应Ⅰ为CH3-CH(CH3)-CH2-CH2Br在乙醇作用下与NaOH反应生成烯烃,为消去反应,方程式为CH3-CH(CH3)-CH2-CH2Br+NaOH$→_{△}^{乙醇}$ CH3-CH(CH3)-CH=CH2+NaBr+H2O,反应Ⅱ为(CH3)2CHCH2CH2OH与氢溴酸发生取代反应生成(CH3)2CHCH2CH2Br,反应的化学方程式为: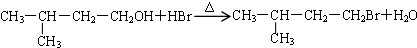 ,C与E反应的化学方程式为
,C与E反应的化学方程式为 ,
,
故答案为:CH3-CH(CH3)-CH2-CH2Br+NaOH$→_{△}^{乙醇}$ CH3-CH(CH3)-CH=CH2+NaBr+H2O;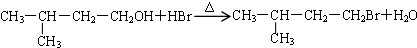 ;
; ;
;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,则它们的结构简式为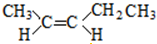 、
、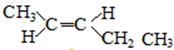 ,
,
故答案为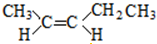 、
、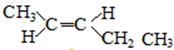 .
.
点评 本题考查有机物的推断,题目难度中等,涉及卤代烃、醇、醛、羧酸的性质与转化,通过计算正确判断A的分子式为解答关键,再结合反应条件进行推断,侧重考查学生分析推理能力,注意熟练掌握常见官能团的结构及其性质.


科目:高中化学 来源: 题型:选择题
| A. | 10g46%的乙醇溶液所含氢原子数为1.2 NA | |
| B. | 0.5 mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24 L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4 g,其中所含硫原子数为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
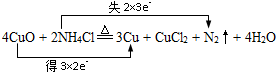 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )
利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 湿润红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 浓盐酸附近产生白烟 | NH3与挥发出的HCl反应:NH3+HCl═NH4Cl |
| D | AlCl3溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
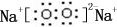 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在屋顶安装太阳能热水器为居民提供生活用水 | |
| B. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 | |
| C. | 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气作为家庭燃气 | |
| D. | 大力发展火力发电,解决广东电力紧张问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com