
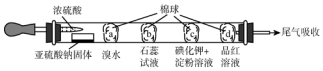
| 选项 | 现象 | 解释和结论 |
| A | a处橙色褪去 | 还原性:Br->SO2 |
| B | b处先变为红色后褪色 | SO2能与H2O反应,且有漂白性 |
| C | c处变为蓝色 | SO2具有一定的氧化性 |
| D | d处红色褪去 | SO2具有漂泊性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.a处二氧化硫与溴水发生氧化还原反应;
B.b处二氧化硫与水反应生成亚硫酸;
C.c处溴与KI发生氧化还原反应;
D.d处品红溶液褪色.
解答 解:A.a处二氧化硫与溴水发生氧化还原反应,生成硫酸和HBr,可说明SO2的还原性较强,故A错误;
B.b处二氧化硫与水反应生成亚硫酸,为酸性物质,使石蕊变红,故B错误;
C.溴水易挥发,c处溴水与KI发生氧化还原反应,生成碘单质,淀粉变蓝,不能体现二氧化硫的氧化性,故C错误;
D.d处品红溶液褪色,则体现二氧化硫的漂白性,故D正确;
故选D.
点评 本题考查二氧化硫的性质,为高频考点,把握发生的反应及现象的分析为解答的关键,注意二氧化硫的还原性、漂白性,选项C为易错点,题目难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 1mol氨基(-NH2)中含有电子数目为10NA | |
| C. | 一定条件下,1molN2和3molH2充分反应,转移电子数目为2NA | |
| D. | 常温下,1LPH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 | |
| C. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是二氧化硫 | |
| D. | 浓H2SO4可以用铝制容器贮存,说明常温下铝与浓H2SO4不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 防止爆炸事故发生 | B. | 防止吸潮结块,影响施肥 | ||
| C. | 防止生成难溶于水的物质 | D. | 防止因发生化学反应而跑氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NO2 | B. | N2 | C. | HNO3 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Fe3+ | C. | Fe2+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10min内,X的平均反应速率为0.03mol/(L•min) | |
| B. | 若容器中的气体密度不再发生变化,说明上述反应已达平衡状态 | |
| C. | 10min后Z的浓度为0.7mol/L | |
| D. | 10min内,反应放出的热量为0.3aKJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com