
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | 常见的Y的氢化物具有正四面体结构 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题
实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.
在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的原料是重金属铅,儿童在使用时不可以用嘴吮吸铅笔,以免引起铅中毒 | |
| B. | CO有毒,生有煤炉的居室放置数盆清水,这样可有效的吸收CO,防止煤气中毒 | |
| C. | 汽水浇灌农田有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用 | |
| D. | 纯碱又名烧碱,成分是氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
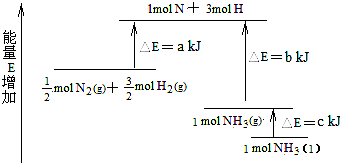
| A. | N2(g)+H2(g)=NH3(l)△H=+(b+c-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=+2(b-a)kJ•mol-1 | |
| C. | N2(g)+3H2(g)=2NH3(l)△H=-2(b+c-a)kJ•mol-1 | |
| D. | N2(g)+H2(g)=NH3(g)△H=+(a+b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Na>K>Rb | B. | 沸点:NH3<PH3<AsH3 | ||
| C. | 热稳定性:PH3>H2O>HF | D. | 酸性:HClO>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
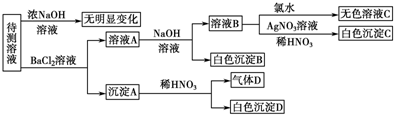
| 肯定存在的离子 | 肯定没有的离子 | |
| 化学式或离子符号 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com