
| amol |
| 4mol |
2mol+
| ||
8mol+
|
| 1 |
| 3 |


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
| 选项 | 化学反应 | 离子方程式 | 评价 | |||||||||||||||
| A | 碳酸钙与醋酸反应 | C
|
错误,碳酸钙是弱电解质,不应写成离子形式 | |||||||||||||||
| B | 向碳酸钠溶液中滴加过量的盐酸 | C
|
正确 | |||||||||||||||
| C | 向澄清石灰水中滴加少量KHC
|
HC
|
错误,不满足Ca(OH)2的配比 | |||||||||||||||
| D | 硫酸氢钠溶液与足量氢氧化钡溶液混合 | 2H++S
|
正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B、将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
| C、pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3) |
| D、pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、已知
| ||||||||||
B、常温下
| ||||||||||
| C、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3?H2O | ||||||||||
| D、向浓度均为0.1 mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:
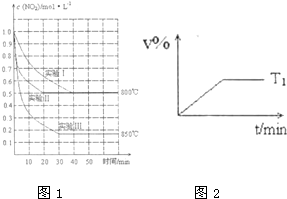 体积为2L的密闭容器中反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验I、II都在800℃、实验III在850℃;NO、O2的起始浓度都为0,NO2 的浓度随时间的变化如图所示.请回答下列问题:
体积为2L的密闭容器中反应2NO2(g)?2NO(g)+O2(g)在三种不同条件下进行,其中实验I、II都在800℃、实验III在850℃;NO、O2的起始浓度都为0,NO2 的浓度随时间的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化较小 |
| B、等温下,等浓度的CH3COOH和HCN溶液pH,后者大 |
| C、HCN溶液和NaOH不等体积混合后一定存在如下关系c(H+)-c(OH-)═c(CN-)-c(Na+) |
| D、0.1mol?L-1CH3COOH和HCN溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以乙烯为原料合成化合物C的流程如图所示:
以乙烯为原料合成化合物C的流程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

3+ 1-x |
| r | 3+ x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com