
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
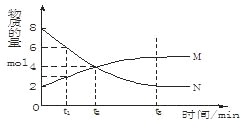
下列表述中正确的是
A.反应的化学方程式为: M![]() NB.t2时,正逆反应速率相等,达到平衡
NB.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍
【答案】D
【解析】
A.N随着时间的推移物质的量减小,N为反应物,M随着时间的推移物质的量增大,M为生成物,0~t2时间段内,N减少物质的量为8mol-4mol=4mol,M增加物质的量为4mol-2mol=2mol,转化N与M物质的量之比为4mol:2mol=2:1,则反应的化学方程式为2NM,A错误;
B.t2时,N、M物质的量没有保持不变,反应没有达到平衡状态,正逆反应速率不相等,B错误;
C.t3时,N、M物质的量保持不变,反应达到平衡状态,正逆反应速率相等,C错误;
D.t1时,N物质的量(6mol)是M物质的量(3mol)的2倍,N的浓度是M浓度的2倍,D正确;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】从废钴酸锂电池正极片(LiCoO2、乙炔炭黑、Al箔)中回收钴和锂的流程如图:下列说法错误的是( )
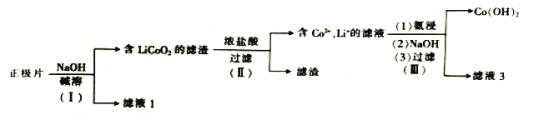
A.步骤(Ⅰ)中的滤液1中含有AlO2-
B.步骤(Ⅱ)中的浓盐酸可用浓硝酸代替
C.步骤(Ⅲ)中的滤液3可用于回收锂
D.合理处理废旧电池有利于保护环境和资源再利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
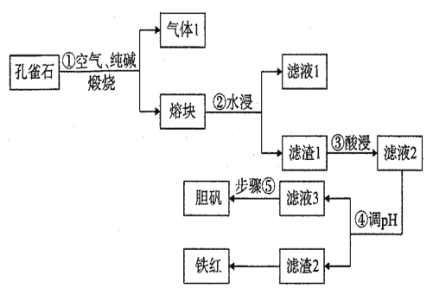
(1)气体1的成分除H2O(g)外,还有CO2、SO2,写出步骤①中发生氧化还原反应的化学方程式为 _______________,若反应生成1mol SO2,则反应中转移的电子数为___________mol。滤液1的主要成分为__________(写化学式)
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有_________________(答出两点)。
(3)步骤④调pH所用试剂为_____________ (写化学式)
(4)常温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=___________。
(5)步骤⑤操作为_______________________________________________________.。
(6)假设使用孔雀石矿石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则:
①铁红的用途之一为________,
②孔雀石矿石中铁元素的含量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如下图所示。下列有关该有机物说法正确的是
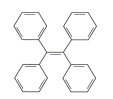
A. 分子式为C26H22 B. 属于苯的同系物
C. 一氯代物有3种 D. 能溶于水和酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH =﹣566 kJ/mol
2CO2(g) ΔH =﹣566 kJ/mol
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀。则混合气体中CH4和CO的体积比为( )
A.1∶2B.1∶3C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。
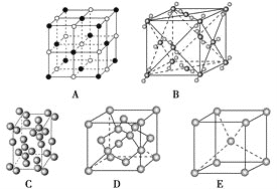
(1)辨别晶胞(请用相应的编号填写)。
①钠晶胞是________;
②碘晶胞是________;
③金刚石晶胞是________;
④干冰晶胞是________;
⑤氯化钠晶胞是________。
(2)与冰的晶体类型相同的是__________。
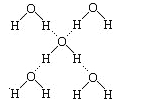
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ·mol-1,除氢键外,水分子间还存在范德华力(11 kJ·mol-1),则冰晶体中氢键的“键能”是________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
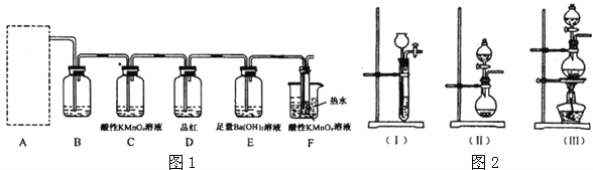
试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计实验探究SO2和漂粉精反应原理,装置如图所示。、
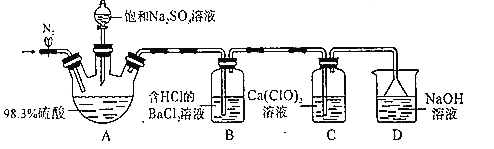
实验操作过程如下:
步骤1:连接装置并检查装置气密性,按如图所示装好药品;
步骤2:打开止水夹,向装置中通入一段时间N2,并关闭止水夹;
步骤3:取下分液漏斗的塞子,旋转活塞,向三颈瓶中滴加饱和Na2SO3溶液。过一会儿,观察到B和C中都产生白色沉淀
步骤4:实验完毕后,检验C中白色固体,白色固体是CaSO4。
回答下列问题:
(1)B装置中盐酸的作用是__;能证明A中产生的“酸雾”含有H2SO4的实验现象是___。
(2)A中硫酸表现出来的性质有__。
(3)步骤2中通入N2的目的是__。
(4)实验完毕后,经检验,D中溶液含有等物质的量浓度的两种还原性盐,写出总反应的离子方程式__。
(5)步骤4检验C中白色沉淀成分的操作是,取少量C中白色固体,滴加足量___(填名称),振荡,白色固体不溶解,则白色固体是CaSO4。
(6)经分析,C中发生化学反应与反应物相对量有关:
若通入少量SO2,则发生反应为3Ca(ClO)2+2SO2+2H2O═2CaSO4↓+4HClO+CaCl2;
若通入过量SO2,则发生反应为Ca(ClO)2+2SO2+2H2O═CaSO4↓+H2SO4+2HCl,SO2+H2OH2SO3。
设计实验证明上述C中通入过量SO2:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com