
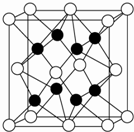
 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):| 1 |
| 8 |
| 1 |
| 2 |
| 4×62 |
| NA |
| 4×62 |
| a3×10-30×NA |
| 4×62 |
| a3×10-30×NA |


科目:高中化学 来源: 题型:
| A、S(g)+O2(g)=SO2(g)放出热量小于297.23kJ |
| B、S(g)+O2(g)=SO2(g)放出热量大于297.23kJ |
| C、S的燃烧热为297.23kJ?mol-1 |
| D、形成1molSO2的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4+2O2
| ||||
B、CaCO3
| ||||
C、2H2O
| ||||
D、Pb+PbO2+2H2SO4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加稀A溶液 |
| 加热 |
| 加B溶液 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
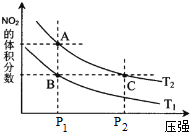
| c(H2)c(CO) |
| c(H2O) |
| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| Nutrition Facts 营养成分 500mL含量 | |
| 热量 710kJ | 碳水化合物 42g |
| 蛋白质 0g | 脂肪酸 0g |
| 维生素C 100mg | |
| 中国居民膳食营养素日推荐摄入量(RNI): 维生素C 100mg | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
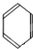 、
、 五种烃,
五种烃,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com