
 有机合成在制药工业上有着极其重要的地位.现用硝基苯制取苯胺,再用苯胺
有机合成在制药工业上有着极其重要的地位.现用硝基苯制取苯胺,再用苯胺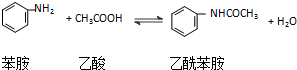
| 物 质 | 相对分 子质量 | 状 态 | 熔点 (℃) | 沸点 (℃) | 溶 解 度(g) | |
| 水 | 乙 醇 | |||||
| 苯 胺 | 93 | 无色液体 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
| 冰醋酸 | 60 | 无色液体 | 17 | 118 | 任意比混溶 | 任意比混溶 |
| 乙酰苯胺 | 135 | 白色片 状固体 | 114 | 304 | 0.56(20℃)、3.45(50℃) 5.20(100℃) | 36.9(20℃) |

 ,可知乙酰苯胺的理论产量为:0.055mol×135g/mol=7.425g因此,上述制备过程的产率是:
,可知乙酰苯胺的理论产量为:0.055mol×135g/mol=7.425g因此,上述制备过程的产率是:| 2.62g |
| 7.425g |


科目:高中化学 来源: 题型:
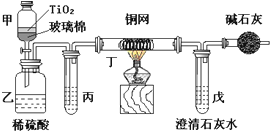 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.查看答案和解析>>
科目:高中化学 来源: 题型:
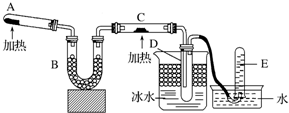 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| NaOH醇溶液 |
| △ |
| H2 |
| Ni/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
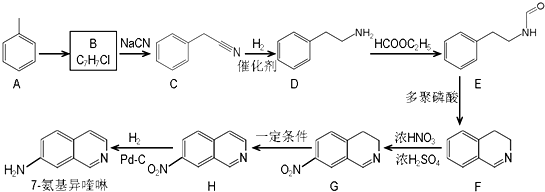
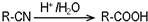 .请回答下列问题:
.请回答下列问题: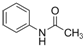 ),请设计合成路线(无机试剂及溶剂任选).
),请设计合成路线(无机试剂及溶剂任选).| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+(Fe2+),加过量铁粉,过滤 |
| B、Mg2+(Al3+),加过量氨水,过滤 |
| C、CO2(HCl),通过碳酸钠饱和溶液,洗气 |
| D、固体Na2CO3(NaHCO3),加热至恒重 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
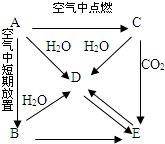 有A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按下图所示的关系相互转化,已知A为单质.按要求回答问题.
有A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按下图所示的关系相互转化,已知A为单质.按要求回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com