
 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点对应的沉淀只有BaSO4 |
| B、c点溶液铝元素以AlO2- 的形式存在 |
| C、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
| 0.025mol |
| 0.1mol.L |


科目:高中化学 来源: 题型:
| A、①②③④ | B、③④①② |
| C、④①③② | D、②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
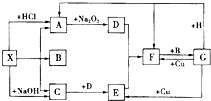 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝热反应属于吸热反应 |
| B、若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应 |
| C、H2→H+H的变化需要吸收能量 |
| D、吸热反应是指需要加热才能进行的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na→Na2O2 |
| B、Si→H2SiO3 |
| C、CuSO4→CuCl2 |
| D、Cu(OH)2→CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体摩尔体积的值为22.4L/mol |
| B、阿伏伽德罗常数的值为6.02×1023 |
| C、1mol硫酸的质量为98g,硫酸的摩尔质量为98g/mol |
| D、将40 g NaOH溶解于1 L水中所得溶液中溶质的物质的量浓度为1 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com