实验室需要480mL 0.1mol/L的Na2CO3溶液,现进行配制.回答下列问题:
(1)应用托盘天平称取碳酸钠晶体的质量为______.
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体的质量为______.(1g以下用游码)
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、玻璃棒、烧杯、______、______.
(4)若实验遇下列情况,溶液的浓度会受何影响.(填“偏高”、“偏低”或“不变”)
A.配制前容量瓶内仍有蒸馏水而未干燥处理______
B.忘记将洗涤液转移至容量瓶______
C.加水时越过刻度线______
D.称取的碳酸钠晶体因风化已失去部分结晶水______.
【答案】
分析:(1)根据m=nM=CVM计算具体的质量,注意溶液的体积是500mL而不是480mL;
(2)实际称量的碳酸钠晶体的质量=砝码的质量-游码的质量;
(3)根据各仪器的作用选取仪器;
(4)根据C=
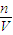
判断,如果n偏小或V偏大,则配制溶液的浓度偏低,如果n偏大或V偏小,则配制溶液浓度偏大.
解答:解:(1)m=nM=CVM=0.1mol/L×0.5L×286g/mol=14.3g,故答案为:14.3g;
(2)实际称量的碳酸钠晶体的质量=砝码的质量-游码的质量=14g-0.3g=13.7g,故答案为:13.7g;
(3)还需要配制溶液的500mL容量瓶、用于定容的胶头滴管,故答案为:500mL容量瓶、胶头滴管;
(4)A.配制前容量瓶内仍有蒸馏水而未干燥处理,溶质的物质的量和溶液的体积都不改变,所以配制溶液浓度不变;
B.忘记将洗涤液转移至容量瓶,溶质的物质的量减小,则配制溶液浓度偏低;
C.加水时越过刻度线,溶液体积偏大,则配制溶液浓度偏低;
D.称取的碳酸钠晶体因风化已失去部分结晶水,溶质的物质的量偏大,则配制溶液浓度偏高;
故答案为:不变、偏低、偏低、偏高.
点评:本题考查一定物质的量浓度溶液的配制,易错点是计算溶质的质量,很多同学将溶液的体积认为是480mL而导致出错.

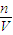 判断,如果n偏小或V偏大,则配制溶液的浓度偏低,如果n偏大或V偏小,则配制溶液浓度偏大.
判断,如果n偏小或V偏大,则配制溶液的浓度偏低,如果n偏大或V偏小,则配制溶液浓度偏大.

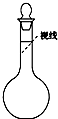 实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:
实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤: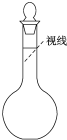 实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:
实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤: