
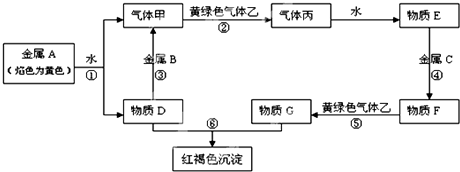
分析 金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸,氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{Cl_{2}}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题.
解答 解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸,氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl$\stackrel{金属C}{→}$物质F$\stackrel{Cl_{2}}{→}$物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)由以上分析可知,B为Al,G为FeCl3,故答案为:Al;FeCl3;
(2)反应②为氢气与氯气反应生成氯化氢,反应的化学方程式为H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,
反应④为铁和盐酸的反应,生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,
反应⑤氯化亚铁与氯气反应生成氯化铁,反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;
故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;Fe+2H+=Fe2++H2↑;2Fe2++Cl2═2Fe3++2Cl-.
点评 本题是考查物质推断与性质、常用化学用语,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.


科目:高中化学 来源: 题型:选择题
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( )| A. | 原子半径:rW>rZ>rY>rX | |
| B. | Y的氧化物是酸性氧化物,不与任何酸反应 | |
| C. | 最简单气态氢化物的热稳定性:H2W>ZH4 | |
| D. | X元素的非金属性比Y元素的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 见光易分解的AgBr常用做感光材料 | B. | 浓硝酸可刻蚀石英制艺术品 | ||
| C. | 84消毒液的有效成分是NaClO | D. | 浓氨水可检验氯气管道泄漏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,28 g N2含有的分子数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 标准状况下,1mol CCl4的体积约为22.4 L | |
| D. | 2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=10mL时,溶液中有关粒子浓度大小关系为:c(Na+)>c(B2-)>c(HB-)>c(H2B)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2B溶液混合后其溶液中,水的电离程度被促进 | |
| C. | 向NaHB溶液中加水稀释,溶液中c(Na+),c(B2-),c(HB-),c(OH-)均减小 | |
| D. | 当V(NaOH)=10mL时,溶液中存在下列关系c(H2B)+c(H+)=c(OH-)+c(B2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(HCl),选用饱和NaHCO3溶液 | |
| B. | NaHCO3溶液(Na2CO3),应通入CO2气体 | |
| C. | Na2O2粉末(Na2O),将混合物在空气中加热 | |
| D. | 镁粉(铝粉),选用过量的烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3在水溶液中水解:HCO3-+H2O?H3O++CO32- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
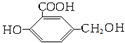 Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )
Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com