
 学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加滴加过量2mol/LHCl(1分)和1mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子. |
分析 (1)氯气具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;
(2)步骤一:检验硫酸根离子,应先排除亚硫酸根离子干扰,盐酸的酸性强于亚硫酸,可以用盐酸排除亚硫酸根离子的干扰;
步骤二:除去亚硫酸根离子和硫酸根离子;
步骤三:检验氯离子的存在;
(3)②依据高锰酸钾具有强的氧化性选择滴定管类型;
③由5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O计算.
解答 解:(1)氯气有氧化性,能和碘化钾反应生成碘单质,碘遇淀粉变蓝色.能与氯化亚铁反应生成氯化铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:溶液变蓝色;2Fe2++Cl2═2Fe3++2Cl-;
(2)步骤一:检验硫酸根离子,应先排除亚硫酸根离子干扰,滴加过量2mol/LHCl(1分)和1mol/LBaCl2溶液,振荡,若产生的白色沉淀,则洗气瓶B溶液中存在SO42-,;
步骤二:除去亚硫酸根离子和硫酸根离子,可用过量l mol/LBa(NO3)2溶液;
步骤三:检验氯离子存在,用硝酸银检验,再用稀硝酸确认,可用0.1mol/LAgNO3溶液和过量的2mol/LHNO3,若产生白色沉淀,则洗气瓶B溶液中存在Cl-,
故答案为:
| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加 滴加过量2mol/LHCl(1分)和1mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加 滴加入过量lmol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加 0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子. |
点评 本题以氯气的制备为载体考查了氯气制备、氯气的性质、离子的检验、滴定法测量物质的含量,题目综合性较强,难度中等,熟悉氯气性质是解题关键.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
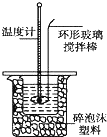 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4↓+Al(OH)3↓ | |
| B. | C点对应的沉淀是:Fe(OH)3和BaSO4 | |
| C. | OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ | |
| D. | 据图计算原溶液中:c(Cl-)=c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com