

分析 (1)氯气可与氢氧化钠溶液反应;
(2)利用SO2尾气、废铁屑、空气、水合成绿矾(FeSO4•7H2O),S、Fe元素化合价升高,被氧化;
(3)FeCO3高温煅烧可得Fe2O3,反应的方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(4)Ge(OH)CO3→GeO2,失去一个电子,O2→2O2-,得到4个电子,所以得失电子最小公倍数是4,则Ge(OH)CO3的计量数是4,O2的计量数是1;
(5)该反应中Fe元素化合价由+3价变为+6价,O元素化合价由-2价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式.
解答 解:(1)氯气可与氢氧化钠溶液反应而被吸收,故答案为:NaOH溶液;
(2)利用SO2尾气、废铁屑、空气、水合成绿矾(FeSO4•7H2O),S、Fe元素化合价升高,被氧化,则作还原剂的物质是SO2、废铁屑,故答案为:SO2、废铁屑;
(3)FeCO3高温煅烧可得Fe2O3,反应的方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(4)Ge(OH)CO3→GeO2,失去一个电子,O2→2O2-,得到4个电子,所以得失电子最小公倍数是4,则Ge(OH)CO3的计量数是4,O2的计量数是1,然后根据原子守恒平衡,所以该反应方程式为4Ge(OH)CO3+1O2═4GeO2+4CO2+2H2O,
故答案为:4;1;4;4;2.
(5)该反应中Fe元素化合价由+3价变为+6价,O元素化合价由-2价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,故答案为:4;10;4;8;3.
点评 本题综合考查氧化还原反应,为高频考点,氧化还原反应的计算以及氧化还原反应方程式配平等知识点,会根据原子守恒、转移电子守恒配平方程式,题目难度中等.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
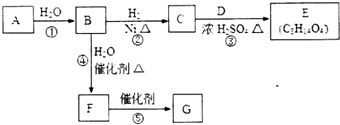 烃的含氧衍生物A是一种重要的有机合成中间体,分子式为C4H2O3,具有五元环结构.由A可以合成有机物E和高分子化合物G,有关物质的转化关系如图所示:
烃的含氧衍生物A是一种重要的有机合成中间体,分子式为C4H2O3,具有五元环结构.由A可以合成有机物E和高分子化合物G,有关物质的转化关系如图所示: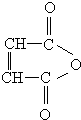 ,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.
,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.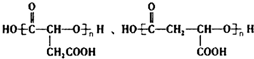 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅可用于制造计算机芯片 | B. | 自然界中存在大量单质硅 | ||
| C. | 地壳中硅的含量稀少 | D. | 光导纤维的主要成分是Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、Na2O2、NH4Cl | B. | HCl、H2O、Cl2 | ||
| C. | MgCl2、NaF、KOH | D. | Xe、H2SO4、HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3和盐酸 | B. | Ca(OH)2和CO2 | C. | Na和O2 | D. | AlCl3与NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外M层全部充满,N层有一个未成对电子 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com