

| A、甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象 |
| B、乙是等PH值的MCl2和NCl2溶液稀释时PH值变化图,由此可推测M的金属性较强 |
| C、由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)=2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ?mol-1 |
| D、丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图 |


科目:高中化学 来源: 题型:

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溴的四氯化碳溶液除去甲烷中混有的少量乙烯气体 |
| B、向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入少量新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉还没有发生水解 |
| C、用硝酸酸化的AgNO3溶液检验CCl4中是否含有氯元素 |
| D、红热的铜丝可以和乙醇发生置换反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2 |
| B、SO2 |
| C、CO2 |
| D、CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
 历史上最早应用的还原性染料是靛蓝.春秋时期,我国先民已能从蓝草中提出这种染料,早于欧洲1500多年.其结构简式如图所示,下列关于靛蓝的叙述,错误的是( )
历史上最早应用的还原性染料是靛蓝.春秋时期,我国先民已能从蓝草中提出这种染料,早于欧洲1500多年.其结构简式如图所示,下列关于靛蓝的叙述,错误的是( )| A、靛蓝由碳、氢、氧、氮4种元素组成 |
| B、它的分子式是C16H10N2O2 |
| C、该物质是高分子化合物 |
| D、它是不饱和的有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X在Y的前一周期 |
| B、X-定是金属元素 |
| C、X、Y可能在同一周期 |
| D、X-定是第三周期II A或ⅣA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 |
| B、升高温度,可提高CO2转化率 |
| C、增加H2的浓度,可提高CO2转化率 |
| D、改用高效催化剂,可增大反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:

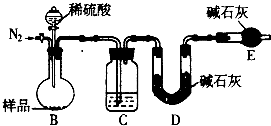
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com