
| A. | 稀硫酸不是分散系 | |
| B. | 一种分散系里只有分散质和分散剂两种物质 | |
| C. | 分散剂一定是液体 | |
| D. | 按分散质和分散剂的状态(气、液、固)有9种组合方式 |
分析 分散系是指一种或多种物质(分散质)分散在两一种物质(分散剂)中所形成的混合体系,可根据定义进行分析解答.
解答 解:A.当分散剂是水或其它溶液时,根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm).稀硫酸是溶液,所以,稀硫酸是分散系,故A错误;
B.分散系是指把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,被分散的物质,称作分散质,起容纳分散质作用的物质,称作分散剂.分散质和分散剂可以有多种物质,故B错误;
C.物质的状态有气、液、固三态,分散质和分散剂可以是气体、液体、固体,故C错误;
D.分散质和分散剂都可以是气体、液体、固体,它们之间相互组合有9种组合方式,故D正确.
故选D.
点评 本题考查的是分散系的概念,主要以选择题或填空题的形式考查,正确理解分散系的概念是解本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 4mol/L | D. | 1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
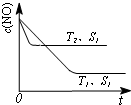 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题: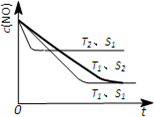 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{22.4}$ mol/L | B. | $\frac{ab}{22400}$ mol/L | ||
| C. | $\frac{ab}{22400+36.5a}$ mol/L | D. | $\frac{1000ab}{22400+36.5a}$ mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84消毒液的有效成分是NaClO | |
| B. | 装饰材料释放的甲醛会造成污染 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | 福尔马林可作食品的保鲜剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
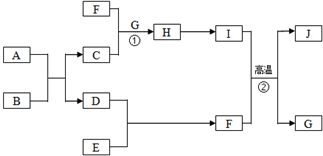 有关物质的转化关系如图所示(部分物质与条件已略去).A是常见的金属单质,B是常见的强酸,E是空气中含量最多的单质,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g•mol-1).请回答下列问题:
有关物质的转化关系如图所示(部分物质与条件已略去).A是常见的金属单质,B是常见的强酸,E是空气中含量最多的单质,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g•mol-1).请回答下列问题: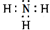 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1771年,法国科学家拉瓦锡发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系 | |
| B. | 化学科学与其他科学分支的联系不密切 | |
| C. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com