
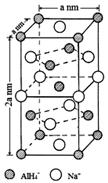
 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键). 分析 (1)Ti原子核外电子数为22,价电子排布式为3d24s2,结合泡利原理、洪特规则画出价电子排布图;
(2)NaH的熔点为800℃,不溶于有机溶剂,应使用离子晶体,用钠离子与氢负离子构成;
(3)氯化铝在178℃时升华,熔沸点较低,属于分子晶体,蒸气的相对分子质量约为267,蒸气分子的分子式为Al2Cl6,铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键;
(4)AlH4-中,Al的轨道杂化数目为4+$\frac{3+1-1×4}{2}$=4,Al采取sp3杂化,为正四面体构型;
(5)以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,根据均摊法可知,晶胞中AlH4-数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+数目为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,则二者配位数相等;
结合晶胞中AlH4-、Na+数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算密度;
若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,再计算Na+数目,而晶胞中AlH4-数目不变,可得化学式;
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,根据原子守恒可知:3NaAlH4→Na3AlH6+2Al+3H2↑.
解答 解:(1)Ti原子核外电子数为22,价电子排布式为3d24s2,价电子排布图为 ,
,
故答案为: ;
;
(2)NaH的熔点为800℃,不溶于有机溶剂,应使用离子晶体,用钠离子与氢负离子构成,电子式为 ,
,
故答案为: ;
;
(3)氯化铝在178℃时升华,熔沸点较低,属于分子晶体,蒸气的相对分子质量约为267,蒸气分子的分子式为Al2Cl6,铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,结构式如图 ,
,
故答案为: ;
;
(4)AlH4-中Al的轨道杂化数目为4+$\frac{3+1-1×4}{2}$=4,Al采取sp3杂化,为正四面体构型,与AlH4-空间构型相同的两种离子为NH4+、SO42-等,
故答案为:sp3杂化;NH4+、SO42-等;
(5)根据均摊法可知,晶胞中AlH4-数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+数目为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;
晶胞质量为4×$\frac{54}{{N}_{A}}$g,晶胞密度为4×$\frac{54}{{N}_{A}}$g÷[(a×10-7 cm)2×2a×10-7 cm]=$\frac{108×1{0}^{21}}{{{N}_{A}a}^{3}}$g•cm-3,
若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,Na+数目为3,而晶胞中AlH4-数目不变,可得化学式Na3Li[AlH4]4,
故答案为:8;$\frac{108×1{0}^{21}}{{{N}_{A}a}^{3}}$;Na3Li[AlH4]4;
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,根据原子守恒可知:3NaAlH4→Na3AlH6+2Al+3H2,反应方程式为:3NaAlH4=Na3AlH6+2Al+3H2↑,
故答案为:3NaAlH4=Na3AlH6+2Al+3H2↑.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、晶体类型与性质、杂化方式与空间构型、晶胞结构与计算等,题目素材中学基本不接触,容易是学生产生畏惧感,侧重考查学生对知识的迁移由于,(6)中注意利用原子守恒进行晶胞,避免考虑结构问题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液一定呈中性 | |
| B. | [OH-]=1×10-6 mol•L-1的溶液一定呈碱性 | |
| C. | [OH-]<[H+]的溶液一定呈酸性 | |
| D. | 室温下由水电离出来的[H+]=1×10-12 mol•L-1的溶液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 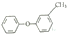 的同分异构体中,有醇、酚、酯类物质 的同分异构体中,有醇、酚、酯类物质 | |
| B. | 1mol 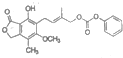 最多能与含5.0molNaOH的水溶液完全反应 最多能与含5.0molNaOH的水溶液完全反应 | |
| C. | 纯净物C4H8的氢种类最多为3种 | |
| D. | 化学式为C8H8的有机物,一定能和溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
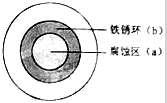 铁及其化合物与生产、生活关系密切,将NaOH溶液滴在一块光亮清洁的铁板表面上,一段时间发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示,请回答下列问题
铁及其化合物与生产、生活关系密切,将NaOH溶液滴在一块光亮清洁的铁板表面上,一段时间发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当X是活泼的金属时,它一定是强碱 | |
| B. | X是得电子能力很强的非金属元素,X-0-H一定为酸 | |
| C. | X-0-H的水溶液不能导电 | |
| D. | X-0-H不可能是直线形的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电时,正极的质量会变小 | |
| B. | 对于某耗氧燃料电池.无论负极通入何种燃料,若转移电子总数相等,则正极消耗等质量的氧气 | |
| C. | 可以通过适当的电解装置实现反应2Ag+2H+=2Ag++H2↑ | |
| D. | 电解精炼铜,阳极为粗铜,电镀铜,阳极为纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5KMnO4=K2MnO4+K3MnO4+K3MnO2+3O2↑ | |
| B. | 2KMnO4=K2MnO4+MnO2+O2↑ | |
| C. | 4KMnO4=2K2MnO4+2MnO2+3O2↑ | |
| D. | 3KMnO4=K3MnO4+2MnO2+2O2↑ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
与3.2 g SO2 所含的氧原子数相等的NO2的质量为
A.2.3 g B.3.2 g C.4.6 g D.6.4 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com