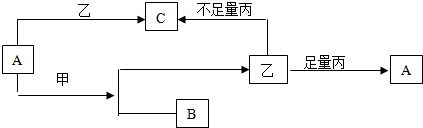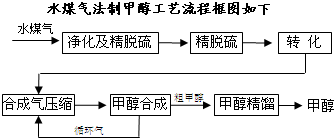
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
除去水蒸气后的水煤气含55~59%的H
2,15~18%的CO,11~13%的CO
2,少量的H
2S、CH
4,除去H
2S后,可采用催化或非催化转化技术,将CH
4转化成CO,得到CO、CO
2和H
2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为:C(s)+H
2O(g)
CO(g)+H
2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为
;
②下列能增大碳的转化率的措施是
;
A.加入C(s) B.加入H
2O(g) C.升高温度 D.增大压强
(2)将CH
4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH
4(g)+
O
2(g)?CO(g)+2H
2O(g)△H=-519KJ/mol.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在T
1℃时催化效率最高,能使正反应速率加快约3×10
5倍;
②Y在T
2℃时催化效率最高,能使正反应速率加快约3×10
5倍;
③Z在T
3℃时催化效率最高,能使逆反应速率加快约1×10
6倍;
已知:T
1>T
2>T
3,根据上述信息,你认为在生产中应该选择的适宜催化剂是
(填“X”或“Y”或“Z”),选择的理由是
;
(3)合成气经压缩升温后进入10m
3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:
2H
2(g)+CO(g)?CH
3OH(g);△H=-90.8kJ?mol
-1,T
4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H
2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol?L-1) |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v
正
v
逆 (填“>”、“<”或“=”).
②若加入CO、H
2后,在T
5℃反应10min达到平衡,c(H
2)=0.4mol?L
-1,则该时间内反应速率v(CH
3OH)=
mol
-1?(L?min)
-1.
(4)生产过程中,合成气要进行循环,其目的是
.

 将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.

 阅读快车系列答案
阅读快车系列答案