
(1)加入少量NaOH(s),FeCl3的水解程度___________(填“增强”“减弱”或“不变”)。
(2)将溶液加热蒸干,并灼热,最后得到的固体是___________(写化学式)。
(3)向FeCl3溶液中通入HCl(g),溶液的pH___________(填“增大”“减小”或“不变”),FeCl3的水解程度___________(填“增强”“减弱”或“不变”)。
(4)向FeCl3溶液中滴加石蕊试液,现象是__________________________________________。
(5)向FeCl3溶液中加入过量的Mg片,现象是_____________________________________。
解析:(1)FeCl3+3H2O![]() Fe(OH)3+3HCl,加入NaOH,NaOH与盐酸反应c(H+)减小,水解平衡正向移动。
Fe(OH)3+3HCl,加入NaOH,NaOH与盐酸反应c(H+)减小,水解平衡正向移动。
(2)将溶液加热蒸干,HCl挥发最后得到Fe(OH)3,将Fe(OH)3灼烧,灼烧产物为Fe2O3。
(3)向溶液中通HCl,c(H+)增大,pH减小,因为c(H+)增大,水解平衡向逆向移动,故水解程度减弱。
(4)FeCl3水解显酸性,故滴加石蕊试液,溶液变红色。
(5)Mg片与FeCl3水解产生的H+反应产生H2,平衡向正向移动,生成红褐色沉淀,Mg的密度小于液体密度,Mg片漂浮。
答案:(1)增强
(2)Fe2O3
(3)减小 减弱
(4)溶液变红色
(5)生成无色气体,Mg片漂浮,生成红褐色沉淀


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
(1)加入少量NaOH(s),FeCl3的水解程度 。(填“增强”“减弱”或“不变”)?
(2)将溶液加热蒸干,并灼烧,最后得到的固体是 。(写化学式)?
(3)FeCl3溶液中通入HCl(g),溶液的pH 。(填“增强”“减小”或“不变”)?
(4)向FeCl3溶液中滴加石蕊试液,现象是 。
(5)向FeCl3溶液中加入过量Mg片,现象是 。
Ⅱ.某同学想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色絮状沉淀,并且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式,并指出制取硫化铝的正确方法。
查看答案和解析>>
科目:高中化学 来源:2013届山西省太原五中高三10月月考理科化学试卷(带解析) 题型:填空题
(8分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为: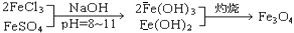
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 ;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
查看答案和解析>>
科目:高中化学 来源:2012届上海市松江区高三上学期期末(1月)考试化学试卷(带解析) 题型:计算题
(本题共16分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
根据题意回答:
1.现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4。
2.如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL。
3.在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 。
4.有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: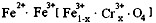 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市松江区高三上学期期末(1月)考试化学试卷(解析版) 题型:计算题
(本题共16分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
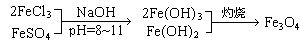
根据题意回答:
1.现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4。
2.如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL。
3.在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 。
4.有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: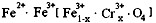 ,现有15.2
g
FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为
。
,现有15.2
g
FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com