
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | 6 | 7 | ||||||
| 3 | 1 | 3 | 5 | 8 | 10 | |||
| 4 | 2 | 4 | 9 |
 H++Cl-+HClO.
H++Cl-+HClO.分析 由元素在周期表的位置可知,1~10分别为Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar,
(1)只有Ar满足最外层8电子稳定结构;
(2)金属性越强,最高价氧化物水化物碱性越强;
(3)7的常见的氢化物为水,与氯气反应生成盐酸和HClO;
(4)1和9的最高价氧化物对应的水化物分别为NaOH、HBrO4;
(5)1和5最高价氧化物对应的水化物反应生成偏铝酸钠和水;
(6)非金属性Cl>Br,非金属性越强,对应氢化物越稳定,对应最高价含氧酸的酸性越强.
解答 解:由元素在周期表的位置可知,1~10分别为Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar,
(1)只有Ar满足最外层8电子稳定结构,则表中元素,化学性质最不活泼的是Ar,故答案为:Ar;
(2)金属性为K>Na>Al,最高价氧化物碱性最强的是KOH,故答案为:KOH;
(3)7的常见的氢化物为H2O,与元素8的单质氯气反应生成盐酸和HClO,离子反应为Cl+H2O H++Cl-+HClO,故答案为:H2O;Cl+H2O
H++Cl-+HClO,故答案为:H2O;Cl+H2O H++Cl-+HClO;
H++Cl-+HClO;
(4)1和9的最高价氧化物对应的水化物分别为NaOH、HBrO4,故答案为:NaOH;HBrO4;
(5)1和5最高价氧化物对应的水化物反应生成偏铝酸钠和水,反应为NaOH+Al(OH)3=NaAlO2+2H2O,故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;
(6)非金属性Cl>Br,非金属性越强,对应氢化物越稳定,对应最高价含氧酸的酸性越强,则氢化物的稳定性为HCl>HBr,最高价氧化物对应的水溶液的酸性为HClO4>HBrO4,
故答案为:HCl>HBr;HClO4>HBrO4.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 相同条件下,单质的密度逐渐变小 | D. | 单质的颜色逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA | |
| C. | 加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子 | |
| D. | 0.1mol Na2O2与足是的潮湿的二氧化碳反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

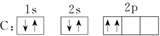
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
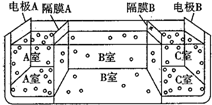
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H与D,16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体 | |
| B. | 元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y | |
| C. | 质量数相同的不同核素,一定属于不同种元素 | |
| D. | HF、HCl、HBr、HI的热稳定性和还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下铁和铂都不溶于浓硫酸 | |
| B. | 硫化钠和硅酸钠固体长期基露在空气中变质 | |
| C. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| D. | SO2 和漂白液都能使品红溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com