
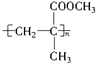
 关于它的叙述不正确的是( )
关于它的叙述不正确的是( )| A. | 该有机玻璃的化学名称为聚甲基丙烯酸甲酯 | |
| B. | 该有机玻璃可用2-甲基丙烯酸和甲醇为原料,通过酯化反应、加聚反应制得 | |
| C. | 它在一定条件下发生水解反应时,可得到另外一种高分子化合物 | |
| D. | 等物质的量的有机玻璃和2-甲基丙烯酸甲酯耗氧量相同 |
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
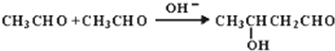

 .E中含氧官能团的名称为羟基、醛基.
.E中含氧官能团的名称为羟基、醛基.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
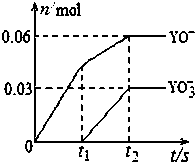
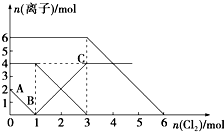 已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为6 mol | |
| C. | 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO${\;}_{3}^{-}$、Cl- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、AlO${\;}_{2}^{-}$、OH- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO${\;}_{4}^{2-}$、S2-、SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )| A. | 既可以催化加氢,又可以使酸性高锰酸钾溶液褪色 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 | |
| C. | 1mol该化合物最多可以与7molNaOH反应 | |
| D. | 可以与Br2的CCl4溶液发生加成反应,但不可以在光照下与Br2发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

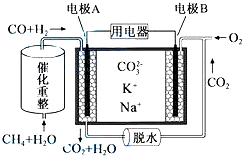
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色. |
| D | 最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
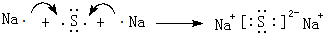 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁烯 | B. | 2-乙基丙烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 2,2-二甲基-3-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为手性异构体的分子具有完全相同的组成和原子排列 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 冰晶体具有空间网状结构,是原子晶体 | |
| D. | 非极性分子中,各原子间都应以非极性键结合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com