
| A. | SO2为0.5mol/L、O2为0.2mol/L | B. | SO2为0.25mol/L | ||
| C. | SO2、SO3均为0.15mol/L | D. | SO3为0.4mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,
2SO2(g)+O2(g)?2SO3(g),
某时刻 0.2mol/L 0.1mol/L 0.2mol/L
极限转化 0.4mol/L 0.2mol/L 0
极限转化 0 0 0.4mol/L
据此判断分析.
解答 解:2SO2(g)+O2(g)?2SO3(g),
某时刻 0.2mol/L 0.1mol/L 0.2mol/L
极限转化 0.4mol/L 0.2mol/L 0
极限转化 0 0 0.4mol/L
A、SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度分别为0.4mol/L、0.2mol/L,三氧化硫不可能完全转化,故A错误;
B、SO2为0.25mol/L,SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度为0.4mol/L,实际浓度为0.25mol/L,小于0.4mol/L,可能存在,故B正确;
C、反应物、生产物的浓度不可能同时减小,只能一个减小,另一个增大,故C错误;
D、SO3为0.4mol/L,SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度为0.4mol/L,达到平衡的实际浓度应该小于0.4mol/L,故D错误;
故选B.
点评 本题考查可逆反应,注意可逆反应的特点为不完全转化性,学生应学会利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度,难度不大.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
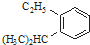 的炔烃的结构简式
的炔烃的结构简式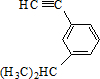 ;
; ;
;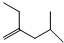 .
.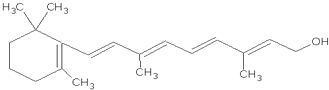 1mol维生素A最多能与5mol溴发生加成反应.
1mol维生素A最多能与5mol溴发生加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υD=0.4mol/(L•s) | B. | υC=0.5mol/(L•s) | C. | υB=0.6mol/(L•s) | D. | υA=0.22mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
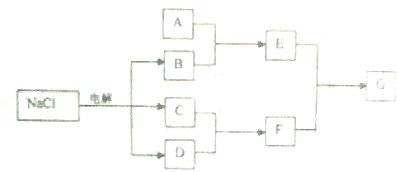
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R是HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com