
【题目】工业上制备H2的一种重要方法是:CO(g)+H2O(g)CO2 (g)+H2(g)△H=QkJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |

(1)Q0(填“>”、“=”或“<”).
(2)若在850℃时向反应容器中充人H2O(g),K值(填“增大”、“减小”或“不变”).
(3)上表中 c2为mol/L,CO(g)的转化率为 .
【答案】
(1)<
(2)不变
(3)0.18;60%
【解析】解:(1)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故△H<0,所以答案是:<;(2)在850℃时向反应容器中充入H2O(g),平衡正向移动,但K值不变;所以答案是:不变;(3)CO+H2O(g)CO2 +H2 , 起始(mol/L)0.200 0.300 00
反应(mol/L) aa a a
平衡(mol/L)0.200﹣a 0.300﹣a a a
K= ![]() =1,解得a=0.12,
=1,解得a=0.12,
所以c2=0.300﹣a=0.18,CO(g)的转化率为 ![]() ×100%=
×100%= ![]() ×100%=60%,所以答案是:0.18;60%.
×100%=60%,所以答案是:0.18;60%.
【考点精析】关于本题考查的等效平衡,需要了解在条件不变时,可逆反应不论采取何种途径,即由正反应开始或由逆反应开始,最后所处的平衡状态是相同;一次投料或分步投料,最后所处平衡状态是相同的,某一可逆反应的平衡状态只与反应条件(物质的量浓度、温度、压强或体积)有关,而与反应途径(正向或逆向)无关才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】LiOH是制取锂和锂的化合物的原料,用电解法制备LiOH的工作原理如下图所示:

下列叙述不正确的是
A. b极附近溶液的pH减小
B. a极发生的反应为2H2O-4e-===O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1mol电子时,可得到1mol LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B. 用铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D. 用FeCl3溶液腐蚀印刷电路板上铜箱:2Fe3++Cu=2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.放电时负极附近溶液的碱性不变
B.充电过程是化学能转化为电能的过程
C.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
D.放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的腐蚀.请写出正极反应式: .
②若开始时开关K与b连接时,两极均有气体产生,则N端是电源的极(填正或负),则总反应的离子方程式为 .
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠. ①制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)导出.通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②通电开始后,阴极附近溶液pH会增大,请简述原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应中,升高温度,平衡常数减小的是( )
A.2SO3?2SO2+O2
B.H2PO ![]() +H2O?HPO
+H2O?HPO ![]() +H3O+
+H3O+
C.Fe3++3H2O?Fe(OH)3+3H+
D.CH3COOH+OH﹣?CH3COO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
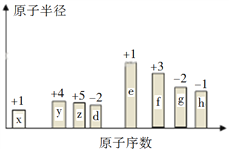
请回答下列问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_________________;比较g、h的最高价氧化物对应的水化物的酸性强弱:________________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1 mol·L1 R溶液的烧杯中滴加1 mol·L1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
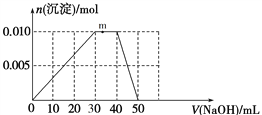
①写出m点反应的离子方程式_____________________________。
②若R溶液改加20 mL1.2 mol·L1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是
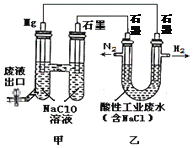
A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
【答案】D
【解析】A、甲中活泼金属镁作原电池的负极,石墨为正极形成原电池,乙是连接原电池的电解池,电解酸性工业废水,电解池是将电能转变为化学能的装置,选项A正确;B、酸性条件下含氮离子氧化时转化为氮气,反应的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+,选项B正确;C、若生成H2和N2的物质的量之比为3:1,根据电极反应6H++6e-=3H2↑、3Cl2 + 2NH4+=N2 + 6Cl-+8H+,则处理后废水的H+浓度增大,pH减小,选项C正确;D、电池工作时,甲池是原电池,原电池中阳离子Na+移向正极石墨电极,选项D不正确。答案选D。
【题型】单选题
【结束】
7
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com