
下列说法正确的是()
A. 将AgCl放入水中不能导电,故AgCl不是电解质
B. CO2溶于水得到的溶液能导电,所以CO2是电解质
C. 金属能导电,所以金属是电解质
D. 固态的NaCl不导电,熔融态的NaCl能导电,NaCl是电解质
考点: 电解质与非电解质.
专题: 电离平衡与溶液的pH专题.
分析: 在水溶液中或熔融状态下能导电的化合物是电解质,在水溶液中或熔融状态下都不能导电的化合物叫非电解质;能导电的物质有自由电子或自由移动的离子,如金属或熔融态盐或酸、碱、可溶性盐溶液等.
解答: 解:A、AgCl的溶解度很小,导致将AgCl放入水中不能导电,但氯化银在熔融态能电离出自由移动的阴阳离子,所以是电解质,故A错误;
B、二氧化碳溶于水能导电,但电离出自由移动离子的是碳酸不是二氧化碳,所以二氧化碳是非电解质,故B错误;
C、金属能导电,但金属不是化合物,所以既不是电解质也不是非电解质,故C错误;
D、固态的NaCl不导电,熔融态的NaCl有自由移动的离子,所以能导电,故NaCl是电解质,故D正确.
故选D.
点评: 本题考查了电解质与导电性的关系,难度不大,注意导电的不一定是电解质,电解质不一定能导电.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
“类推”的思维方式在化学学习与研究中经常采用,但有时会产生错误结论.下列类推结论中,正确的是()
A. 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃
B. 由Na2O中阴阳离子个数比为1:2,可推出Na2O2中阴阳离子个数比为 1:1
C. 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应
D. 由“2Fe+3Br2═2FeBr3”反应可推出“2Fe+3I2═2FeI3”反应也能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法中不正确的是()
A. 一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B. 1molFeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C. 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D. 125gCuSO4•5H2O晶体中含有0.5NA个Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe,I2,他们使用的药品和装置如如所示.
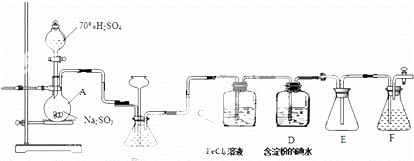
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好.装置E的作用是 .装置F中为NaOH溶液.
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是 (填离子符号).
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是方案①,原因是 .
(5)能表明I﹣的还原性弱于SO2的现象是 ,写出有关离子方程式: ﹣.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 单位物质的量的气体所占的体积就是气体摩尔体积
B. 摩尔是物质的量的单位
C. 阿伏加德罗常数就是6.02×1023
D. CO2的摩尔质量为44g
查看答案和解析>>
科目:高中化学 来源: 题型:
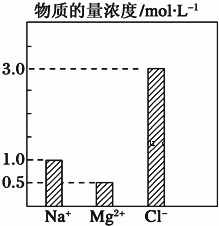
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合液中含溶质MgCl2的物质的量为 ,
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,
(1))请写出NO2和CO反应的热 化学方程式: 已知:N2 (g)+2NO2 (g)⇌4NO(g)△H=+292.3kJ•mol﹣1,
化学方程式: 已知:N2 (g)+2NO2 (g)⇌4NO(g)△H=+292.3kJ•mol﹣1,
则反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) 的△H= ;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)⇌2N2O5(g);已知体系中n(NO2)随时间变化如表:
t(s) 0 500 1000 1500
N(NO2)(mol) 20 13.96 10.08 10.08
写出该反应的平衡常数表达式:K= ,
已知:K3000C>K3500C,则该反应是 反应(填“放热”或“吸热”).

查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是()
组别 c(HCl)(mol/L) 温度(℃) 状态
1 2.0 25 块状
2 2.5 30 块状
3 2.5 50 块状
4 2.5 30 粉末状
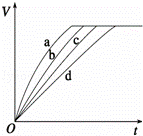
A. 4﹣3﹣2﹣1 B. 1﹣2﹣3﹣4 C. 3﹣4﹣2﹣1 D. 1﹣2﹣4﹣3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com