
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
分析 A.过氧化钠与水反应时,氧元素的价态一半由-1价变为0价,一半降为-2价;
B.依据钠与水反应方程式计算解答;
C.氮气与氢气都是双原子分子;
D.根据反应后铁元素变为+$\frac{8}{3}$价来分析;
解答 解:A.过氧化钠与水反应时,氧元素的价态由-1价变为0价,一半降为-2价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故A错误;
B.钠与水反应方程式:2Na+2H2O=2NaOH+H2↑,46g钠反应生成1mol水,所以23g Na 与足量H2O反应完全后可生成0.5NA个H2分子,故B错误;
C.标准状况下,22.4LN2和H2混合气中含2NA个原子,故C错误;
D.反应后铁元素变为+$\frac{8}{3}$价,故3mol铁失去8mol电子即8NA个,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,熟练掌握公式的运用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷 | |
| B. | 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯 | |
| C. | 将电石和饱和食盐水置于启普发生器中制取乙炔 | |
| D. | 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol | 2.5 | 0.2 |
| ②H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol | 1.0 | 2.3 |
| ③3H2(g)+CO2(g)=CH3OH(g)+H2O(g)△H3 | K3 | 4.6 |
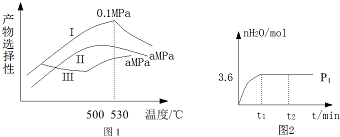
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
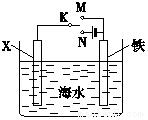 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,不显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

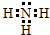 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为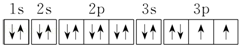 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.0g熔融的NaHSO4中含有的阳离子数为0.2NA | |
| B. | Na2O2与足量CO2反应生成2.24LO2,转移电子数为0.2NA | |
| C. | 4.6gNO2和N2O4混合物中含有的原子总数为0.3NA | |
| D. | 用惰性电极电解1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com