
| A. | 酸性:HI>HBr>HCl>HF | B. | 碱性:Be(OH)2<Mg(OH)2<KOH | ||
| C. | 氧化性:S<O2<F2 | D. | 还原性:O2-<S2-<I- |
分析 A.随着原子序数的递增,卤化氢的酸性逐渐增强;
B.金属性越强,最高价氧化物对应水合物的碱性越强;
C.一般情况下非金属性越强,对应单质的氧化性越强;
D.单质氧化性越强,对应离子的还原性越弱.
解答 解:A.卤素原子的原子序数越大,HX的酸性越强,则酸性强弱为:HI>HBr>HCl>HF,故A正确;
B.金属性:Be<Mg<K,则最高价氧化物对应水合物的碱性:Be(OH)2<Mg(OH)2<KOH,故B正确;
C.非金属性S<O<F,则单质的氧化性:S<O2<F2,故C正确;
D.单质的氧化性:S<I2<O2,则离子的还原性:O2-<I-<S2-,故D错误;
故选D.
点评 本题考查原子结构与元素周期律的应用,题目难度不大,涉及酸性、碱性、氧化性、还原性强弱的判断,明确元素周期律的内容为解答结构,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
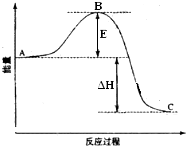 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由弱至强的顺序是X<Y<Z | |
| C. | 原子半径大小顺序是X<Y<Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中的电子总数为12NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 5.85g氯化钠晶体中含有Na+数为0.1NA | |
| D. | 氢气和氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com