
依据氧化还原反应:Zn+2FeCl3===ZnCl2+2FeCl2设计的原电池如图所示:

请回答下列问题:
(1)电极X的 材料是 ,电解质溶液Y是 。
材料是 ,电解质溶液Y是 。
(2)Pt电极为电池的________极,发生的电极 反应为_________ ;X电极上发生的电极反应为________。
(3)该装置中电子从 (填物质)极流出,盐桥中 (填阴、阳)离子向右边烧杯中溶液运动。
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源:2016届宁夏银川二中高三5月适应性训练理综化学试卷(解析版) 题型:实验题
苯甲酸乙酯(C9H10O2)是一种无色透明液体,不溶于水,稍有水果香味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。
(1)其制备方法为:
(2)已知:①
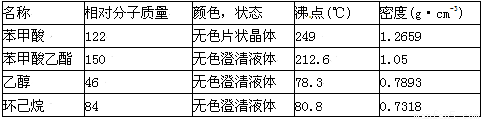
②苯甲酸在100℃会迅速升华
③无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
(3)实验步骤如下:
① 在仪器A中加入12.20 g苯甲酸,25 mL 9 5%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
5%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
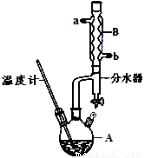
② 反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③ 将仪器A内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,将滤液用蒸馏烧瓶进行分馏,低温蒸出乙醚和环己烷后,继 续升温,接收210~213℃的馏分。
续升温,接收210~213℃的馏分。
④ 检验合格,测得产品体积为12.86 mL。回答下列问题:
(1)在该实验中,仪器A的名称为 ,其容积最适合的是 (填选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)制备苯甲酸乙酯时,最合适的加热方法是 ,控制温度的目的是 。加入沸石的作用是 。
(3)步骤①中使用分水器不断分离除去水的目的是 。
(4)步骤②中应控制馏分的温度在 。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(5)步骤③有机层应从分液漏斗 (填“上口”或“下口”)流出。加入Na2CO3的作用是 ;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是 。加入氯化钙的目的是 。
(6)计算本实验的产率为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末化学试卷(解析版) 题型:选择题
低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是( )
A.Fe位于元素周期表的第四周期、第ⅧB族
B.工业上利用热还原法冶炼金属Fe、Cr、Mn
C.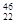 TiO2、
TiO2、 TiO2、
TiO2、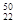 TiO2互为同位素
TiO2互为同位素
D.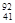 Nb3+原子核内有51个中子,核外有41个电子
Nb3+原子核内有51个中子,核外有41个电子
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市高三高考前最后一卷理综化学试卷(解析版) 题型:实验题
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料设计资源回收的工艺流程如下:
 (1)写出第①步反应的离子方程式 。
(1)写出第①步反应的离子方程式 。
(2)洗涤滤渣B的目的是为了除去 (填离子符号),检验该离子是否洗净的方法是 。
(3)写出第③步反应的化学方程式_________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得
到FeSO4溶液,再经 、 、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为80.00%)1.300g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为 mL。
(可能用到的相对原子质量 H=1 O=16 Ce =140 )
②该电解反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市高三高考前最后一卷理综化学试卷(解析版) 题型:选择题
用H2O2溶液处理含NaCN的废水的反应原理为:NaCN+H2O2+H2O===NaHCO3+NH3,已知:H CN的酸性比H2CO3弱。下列有关说法正确的是
CN的酸性比H2CO3弱。下列有关说法正确的是
A.该反应中氮元素被氧化
B.该反应中H2O2作还原剂
C.0.1mol·L-1NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023
D.实验室配制NaCN溶液时,需加入适量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:选择题
在一定条件下,反应N2+3H2 2NH3 在2 L密闭容器中进行,10 min时NH3的物质的量增加了0.2mol,则反应速率为
2NH3 在2 L密闭容器中进行,10 min时NH3的物质的量增加了0.2mol,则反应速率为
A.υ(H2)=0.02 mol / (L·min)
B.υ(N2)=0.02 mol / (L·min)
C.υ(NH3)=0.01 mol / (L·min)
D.υ(N2)=0.01 mol / (L·min)
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三下学期猜题理综化学试卷(解析版) 题型:选择题
在t℃时.AgI在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5×10-11,下列说法不正确的是( )
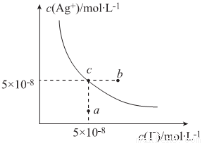
A.在t℃时,AgI的Ksp=2.5×10-15
B.图中b点有碘化银晶体析出
C.向c点溶液中加入适量蒸馏水.可使溶液由c点到a点
D.在t℃时,反应AgBr(s)+I-(aq) AgI(s)+Br-(aq)的平衡常数K=200
AgI(s)+Br-(aq)的平衡常数K=200
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com