
下面是用碳酸钠固体配制250 mL 0.05 mol/L碳酸钠溶液的操作,请按要求填空:
(1)所需碳酸钠的质量为________.
(2)把称量好的药品放在小烧杯中,用蒸馏水进行溶解,用玻璃棒不断搅拌的目的是________.
(3)将上述溶液沿________注入________中,并用蒸馏水洗涤烧杯2~3次,洗涤液要________中,并摇匀.若不洗涤,所配的溶液的浓度将________(填偏高、偏低、无影响)
(4)加水至距刻度线________处,改用________加水,使溶液的凹液面正好跟刻度线相切.若加水超过刻度线,应如何处理________
科目:高中化学 来源:2014届浙江省湖州市八校高三上学期第二次联考化学试卷(解析版) 题型:实验题
硫代硫酸钠(Na2S2O3)可由下面一系列反应制得:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3
+ S  Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;
Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。

Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
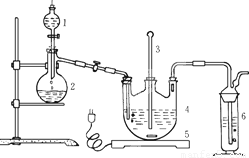
请问:仪器2的名称为 ,
装置6中可放入 。
A.BaCl2溶液 B.浓H2SO4
C.酸性KMnO4溶液 D.NaOH溶液
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:
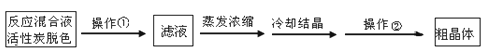
(1)为减少产品的损失,操作①为 ,操作②是 、洗涤、干燥,其中洗涤操作是用 (填试剂)作洗涤剂。
(2)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应: 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为
,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为
,
三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com