
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.含有离子键的化合物是离子化合物,所以离子化合物中都含有离子键,可能含有共价键,故A正确;
B.离子化合物中的阳离子不一定是金属离子,如铵盐,故B错误;
C.含有共价键的化合物可能是离子化合物,如铵盐、KOH等,故C错误;
D.溶于水可以导电的化合物可能是共价化合物,如HCl、硫酸等,故D错误;
故选A.
点评 本题考查化合物和化学键的关系,侧重考查基本概念、物质结构,明确物质的构成微粒即可判断,注意不能根据是否含有金属元素判断离子化合物.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
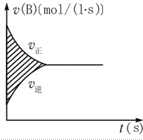
| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
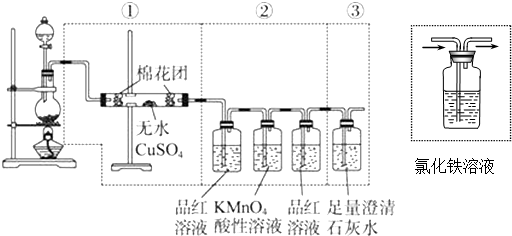
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
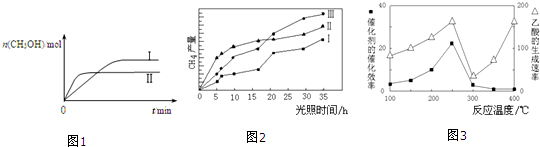
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.11mol | B. | 0.22mol | C. | 0.16mol | D. | 0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com