
| A. | 沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+ | |
| B. | 向反应后的溶液中加入乙醇,有沉淀析出 | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对 | |
| D. | 反应前后,Cu2+浓度不变 |
分析 氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液.
A.氢氧化铜和氨水反应生成配合物[Cu(NH3)4]2+而使溶液澄清;
B.络合物在乙醇中溶解度较小,所以会析出晶体;
C.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键;
D.硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物.
解答 解:氨水呈碱性,向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物氢氧化铜,Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,原因是氢氧化铜和氨水反应生成了铜氨络合物,反应为:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-.
A.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物离子[Cu(NH3)4]2+而使溶液澄清,故A正确;
B.[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体,故B正确;
C.在[Cu(NH3)4]2+离子中,铜离子含有空轨道,氨气分子含有孤电子对,所以Cu2+提供空轨道,NH3给出孤电子对,故C正确;
D.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物而使溶液澄清,铜离子转化到络合物离子中,所以溶液中铜离子浓度减小,故D错误;
故选D.
点评 本题考查了配合物、配位键的形成等性质,题目难度中等,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.注意配位键属于共价键.


科目:高中化学 来源: 题型:多选题
| A. | C作还原剂 | B. | CO2作氧化剂 | ||
| C. | 氧元素化合价降低 | D. | 氧元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是一种洁净的能源,其燃烧产物SiO2粉尘对环境无污染 | |
| B. | Si在空气中完全燃烧放出的热量多 | |
| C. | 自然界硅的蕴藏量很丰富 | |
| D. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
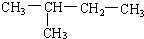 (8)
(8)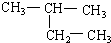 (9)CH2=CH-CH3
(9)CH2=CH-CH3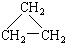 (11)2,2-二甲基丁烷.
(11)2,2-二甲基丁烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0.2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
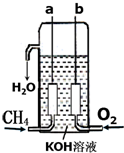 氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com