
| A、14C与12C互为同素异形体 |
| B、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
| C、NOx、CO2、PM2.5颗粒都会导致酸雨 |
| D、避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为外加电流的阴极保护法 |


科目:高中化学 来源: 题型:
| A、1mol过氧化钠固体中所含阴离子的个数为2NA |
| B、标准状况下,11.2L CCl4中含有的C-Cl键的数目为2NA |
| C、1.7g的氢氧根离子中含有的电子数为NA |
| D、用100mL 18.4mol?L-1 的浓硫酸与足量的铜反应,生成SO2的分子数为0.92NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 二氧化锰与浓盐酸反应制干燥氯气 |
B、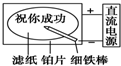 滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用外加保护膜的细铁棒做笔在滤纸上写字显红色字迹 |
C、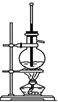 石油的分馏 |
D、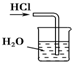 用水吸收氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2溶于水的过程中有2NA个电子转移 |
| B、在1L 0.1mol?L-1氟化钠溶液中含有F-数目为NA |
| C、1mol甲醇中含有C-H键的数目为3NA |
| D、10L pH=1的硫酸溶液中含有的H+数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4溶液中加入H2O2溶液的反应:Fe2++2H2O2+4H+═Fe3++4H2O |
| B、泡沫灭火器的反应原理为:Al3++3HCO3-═Al(OH)3↓+3CO2↑ |
| C、向明矾水溶液中滴加氢氧化钡溶液使SO42-恰好完全沉淀的反应:2Ba2++Al3++2SO42-+3OH-═2BaSO4↓+Al(OH)3↓ |
| D、将溴单质与少量铁加热反应的生成物溶于水,通入足量氯气后发生的反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:
咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中:c(Ca2+)=c(N03-) |
| B、将0.2mol?L-1 NaA溶液和0.1mol?L-1盐酸等体积混合所得的碱性溶液中(A-为酸根离子):c(Na+)>c(A-)>c(Cl-)>c(OH-) |
| C、0.1mol/L NaAl02溶液中:c(Na+)>c(A102-)>c(OH-)>c(H+) |
| D、浓度均为0.1mo1?L-1的CH3COOH、CH3COONa的混合溶液中:2c(OH-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的c(H+)为1×10-4 mol?L-1 |
| B、该溶液lmL稀释至100mL后,pH等于6 |
| C、向该溶液中加入等体积、pH为10的氢氧化钠溶液恰好完全中和 |
| D、该溶液中醋酸电离出的c(H+)与水电离出的c(H+)的比值为106 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com