
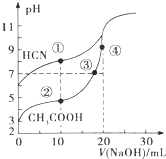
| A. | 点③溶液中,c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| C. | 点④溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
分析 A.点③中pH=7,则c(OH-)=c(H+);
B.根据点①和点②所示溶液中的电荷守恒分析;
C.点④时溶质为醋酸钠,根据点④电荷守恒和溶液的酸碱性判别;
D.点②和点③所示溶液中存在电荷守恒.
解答 解:A.点③中滴入的0.10mol•L-1的CH3COOH溶液体积小于20.00mL,溶质为乙酸钠和乙酸,pH=7,则c(OH-)=c(H+),故A错误;
B.点①的溶液中存在电荷守恒为c(OH-)+c(CN-)=c(Na+)+c(H+),而且c(OH-)>c(H+),点②所示溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),而且c(OH-)<c(H+),二者中钠离子浓度相同,所以点②c(CH3COO-)>点①c(CN-),故B正确;
C.点④溶液中,存在电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+),c(OH-)>c(H+),则c(CH3COO-)<c(Na+),在④点时加入20mL的氢氧化钠溶液,则此时反应的氢氧化钠的物质的量与醋酸的物质的量相等,溶质为醋酸钠,溶液呈碱性为乙酸钠水解,水解程度较小,所以c(CH3COO-)>c(OH-),即c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D.点②和点③所示溶液中存在电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+),在点②所示溶液中,c(OH-)<c(H+),则c(CH3COO-)>c(Na+),在③中c(OH-)=c(H+),c(CH3COO-)=c(Na+),所以在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D正确;
故选A.
点评 本题考查酸碱混合溶液中离子浓度的关系,明确混合后溶液中的溶质是解答的关键,注意电荷守恒和物料守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4N03是离子化合物,KN03是共价化合物 | |
| B. | NH4N03是共价化合物,KN03是离子化合物 | |
| C. | NH4N03和KN03都是离子化合物 | |
| D. | NH4N03和KN03都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的二元弱酸H2R溶液与p=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=(Na+) | |
| B. | 若0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=(H+)=1×10-9mol•L-1 | |
| C. | 0.2mol•L-1HCl溶液与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | 0.1mol•L-1Na2S与0.1mol•L-1NaHS等体积混合:3c(Na+)-2c(HS-)=2c(S2-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大 | |
| C. | 随核电荷数递增,氢氧化物碱性增强 | |
| D. | 随电子层数增加,原子半径增大,金属还原性和金属性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10 mL该溶液稀释至100 mL后,pH=4 | |
| B. | 向该溶液中加入等体积pH为12的氨水恰好完全中和 | |
| C. | 该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 | |
| D. | 该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

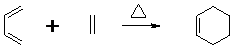
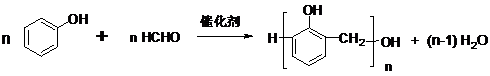
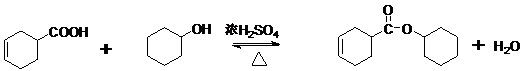
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
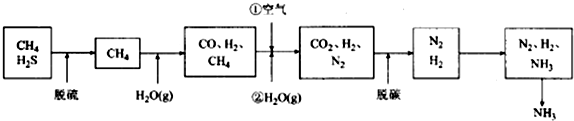
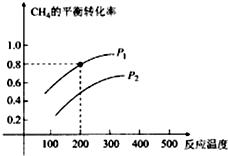
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | |
| A | 2 | 1 | 2 | 1 |
| B | 1 | 1 | 2 | 2 |
| A. | A的转化率为:甲<丙<乙<丁 | B. | A的转化率为:甲<乙<丙<丁 | ||
| C. | B的转化率为:甲>丙>乙>丁 | D. | B的转化率为:丁>乙>丙>甲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com