
 TiCl4+2CO
TiCl4+2CO 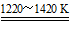 Ti+2MgCl2
Ti+2MgCl2 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
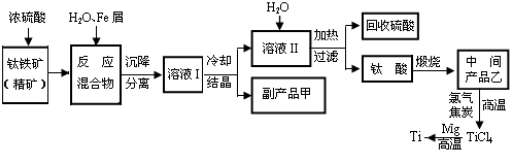
科目:高中化学 来源:2011-2012年重庆西南大学附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg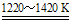 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为_____________________。
(2)与CO互为等电子体的分子是___________。
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______化合物(填“离子”或“共价”)。
② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_____________________________________。
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是____________ (填操作名称)。
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省宝鸡中学高二下学期期末考试化学试卷(带解析) 题型:填空题
钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C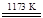 TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg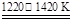 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______晶体。② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_________________________________。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
查看答案和解析>>
科目:高中化学 来源:2014届陕西省高二下学期期末考试化学试卷(解析版) 题型:填空题
钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg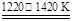 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______晶体。② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_________________________________。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com