等质量的钠、铁、锌三种金属单质分别跟等体积等浓度的稀盐酸反应,下列说法正确的是( )
A.三者产生的氢气一样多
B.锌产生的氢气一定最多
C.铁产生的氢气一定最多
D.钠产生的氢气一定不比其他两种金属少
【答案】
分析:三种金属与盐酸的反应分别是:2Na+2HCl═2NaCl+H
2↑,Fe+2HCl=FeCl
2+H
2↑、Zn+2HCl=ZnCl
2+H
2↑,因是与等体积等浓度的稀盐酸,所以盐酸质量相等,可利用方程式求出生成氢气的物质的量,但钠能和水反应生成氢气2Na+2H
2O=2NaOH+H
2↑,而铁和锌不可以和水反应,据此即可解答.
解答:解:当盐酸少量,金属足量时:
假设等体积等浓度的稀盐酸为2mol盐酸,稀盐酸反应分别跟钠、铁、锌三种金属单质反应,根据反应方程式2Na+2HCl═2NaCl+H
2↑,Fe+2HCl=FeCl
2+H
2↑、Zn+2HCl=ZnCl
2+H
2↑,可知:当生成的氢气均为1mol时,需钠、铁、锌三种金属单质分别为46克、56克、65克,题干中等质量的钠、铁、锌三种金属单质,则均为65克时,钠过量19克、铁过量9克,锌恰好完全反应,而过量的19克钠和水还能发生2Na+2H
2O=2NaOH+H
2↑,生成氢气,而铁不可以和冷水反应,所以等质量的钠、铁、锌三种金属单质分别跟等体积等浓度的稀盐酸反应,此时钠产生的氢气多,锌和铁反应产生的氢气一样多;
当盐酸足量,金属少量时:
假设等体积等浓度的稀盐酸为2mol盐酸,等质量的钠、铁、锌三种金属单质,均为1克,根据反应方程式2Na+2HCl═2NaCl+H
2↑,Fe+2HCl=FeCl
2+H
2↑、Zn+2HCl=ZnCl
2+H
2↑,可知:此时三者产生的氢气分别为
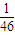
mol,
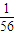
mol,
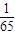
mol,故D正确.
故选D.
点评:本题主要考查了金属钠的化学性质以及金属与酸反应的实质,掌握钠和水反应和依据化学方程式进行熟练分析判断,是解答本题的关键,题目难度不大.

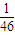 mol,
mol,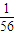 mol,
mol,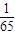 mol,故D正确.
mol,故D正确.
