
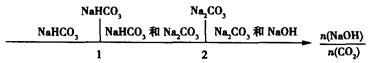
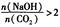 时,溶质的组成为NaOH和Na2CO3;当
时,溶质的组成为NaOH和Na2CO3;当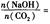 2时,溶质的组成为Na2CO3;当
2时,溶质的组成为Na2CO3;当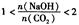 时,溶质的组成为Na2CO3和NaHCO3;当
时,溶质的组成为Na2CO3和NaHCO3;当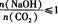 时,溶质的组成为NaHCO3。
时,溶质的组成为NaHCO3。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 |
| B.乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
| C.玛瑙、水晶、钻石的主要成分均为SiO2 |
| D.蛋白质、纤维素、蔗糖、天然橡胶都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Fe(OH)2 | Fe(OH)3 |
| Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H3O++ CO32-
H3O++ CO32-| A.②④⑧ | B.②⑤ | C.③④⑥ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.⑥④⑤②③① | B.④⑥⑤②③① |
| C.⑥④②⑤③① | D.⑥④⑤②①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 沉淀开始时pH | 2.7 | 4.1 | 8.3 |
| 沉淀完全时pH | 3.7 | 5.4 | 9.8 |
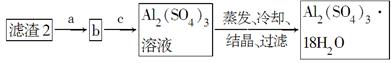
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe溶于一定量稀硝酸中可能生成Fe3+和Fe2+ |
| B.Al(OH)3既能溶于盐酸也能溶于烧碱溶液 |
| C.Cu和过量的S反应生成Cu2S |
| D.NaHCO3和Na2CO3受热都分解出CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸具有强氧化性,但SO2气体可以用浓硫酸干燥 |
| B.常温下实验室可以用稀硝酸与铁反应制取NO气体 |
| C.从海水中提取溴的过程中常鼓入热空气,其目的是氧化Br- |
| D.SiO2不仅能与氢氧化钠溶液反应,也能与氢氟酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com