

分析 (1)电解硫酸氢铵水溶液得到(NH4)2S2O8和H2,电解池中阴极是得到电子发生还原反应;
(2)根据过氧化氢不稳定,受热容易分解分析;根据反应流程中(NH4)2S2O8+2H2O═2NH4HSO4+H2O2反应分析;
(3)根据过氧化氢受热易分解和过氧化氢中氧元素的化合价是-1价,处于中间价态分析判断;
(4)过氧化氢具有氧化性,能把亚铁离子氧化生成铁离子;
(5)在硫酸的作用下,过氧化氢与乙酸反应生成过氧乙酸和水,据此书写方程式.
解答 解:(1)电解硫酸氢铵水溶液得到(NH4)2S2O8和H2,电解池中阴极是得到电子的,所以为溶液中的氢离子放电,方程式是2H++2e-═H2↑,故答案为:2H++2e-═H2↑;
(2)由于过氧化氢不稳定,受热容易分解,所以减小气压,能使液体沸点降低,易于蒸发出;根据反应流程可知,(NH4)2S2O8+2H2O═2NH4HSO4+H2O2,在生成双氧水的同时,还生成NH4HSO4,所以能循环使用的是NH4HSO4,故答案为:过氧化氢不稳定,受热容易分解,减小气压,使液体沸点降低;NH4HSO4;
(3)过氧化氢不稳定,受热易分解,同时过氧化氢中氧元素的化合价是-1价,处于中间价态,因此既有氧化性,还有还原性,故选:ACD;
(4)过氧化氢具有氧化性,能把亚铁离子氧化生成铁离子,再通过调节pH值使铁离子沉淀铜离子不沉淀,则过氧化氢把亚铁离子氧化生成铁离子的离子方程式是2 Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2 Fe2++H2O2+2H+═2Fe3++2H2O;
(5)在硫酸的作用下,过氧化氢与乙酸反应生成过氧乙酸和水,方程式为:CH3COOH+H2O2$\stackrel{H_{2}SO_{4}}{→}$CH3COOOH+H2O,故答案为:CH3COOH+H2O2$\stackrel{H_{2}SO_{4}}{→}$CH3COOOH+H2O.
点评 本题考查了实验制备实验方案设计,同时考查了电解池原理以及过氧化氢的性质,了解物质的性质是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 18g H2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4L CO2含有的分子数目为NA | |
| C. | 1L1mol•L-1Na2SO4溶液中含有钠离子数目为NA | |
| D. | 1mol H2在Cl2中完全燃烧转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,W 的体积分数减小,△H 增大 | |
| B. | 以 Y 的浓度变化表示的反应速率为 0.01 mol/(L•s) | |
| C. | 在其它条件不变的情况下,增加 1 mol X,则 X 和 Y 的转化率均提高 | |
| D. | 再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是9NA | |
| B. | 7.8g 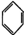 中含有的碳碳双键数为0.3NA 中含有的碳碳双键数为0.3NA | |
| C. | 1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为8NA | |
| D. | 标准状况下,11.2L己烷所含分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com