
NA表示阿伏加德罗常数的值,下列说法正确的是
A.电解硫酸时,阳极产生1molH2时,阴极一定产生0.5molO2
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C.电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝
D.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷(解析版) 题型:填空题
(10分)下图是一个化学过程的示意图。

(1)图中乙池是 装置。
(2)c(Pt)电极的名称是 。
(3)写出通入CH3OH的电极的电极反应式是 。
(4)乙池中反应的离子方程式为 。
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下);此时丙池某电极析出1.6g某金属,则丙中的某盐溶液可能是 (填序号)
A.MgSO4 B.CuSO4 C.NaCl D.CuCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南七校高一上学期期末联考化学试卷(解析版) 题型:选择题
下列各组物理量中,随取水量的变化而变化的是
A.水的沸点 B.水的密度
C.水的物质的量 D.水的摩尔质量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三3月联考理综化学试卷(解析版) 题型:选择题
下图是部分短周期主族元素原子半径与原子序数的关系图。则下列说法正确的是

A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X > Z > M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:填空题
(12分)(1)已知N≡N、N—H、H—H的键能分别为946kJ·mol-1、390.8kJ·mol-1、436.0kJ·mol-1。试根据盖斯定律,写出合成氨反应的热化学方程式 。
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式____________。
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做 极,电极反应式为 ;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________,该电池总反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,下列研究目的和示意图相符的是
2SO3(g) ΔH<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系增加O2的浓度对反应的影响 | 体积恒定的密闭容器中催化剂对反应的影响 |
示 意 图 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
Zn(s)+O2(g)=ZnO(s) ΔH=-Q1 kJ / mol
Hg(l)+O2(g)=HgO(s) ΔH=-Q2kJ / mol
Zn(s)+HgO(s)=Hg(l) +ZnO(s) ΔH=-Q3kJ / mol
Q3值为
A.Q2 - Q1 B.Q1+ Q2 C.Q1- Q2 D.-Q1- Q2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
下列各项表述与示意图一致的是
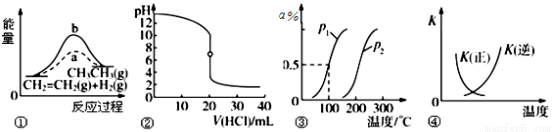
A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g) +ΔQ ,0<ΔQ;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) CO(g)+3H2(g) +ΔQ ,反应CH4的转化率与温度、压强的关系,且p1>p2、0<ΔQ
CO(g)+3H2(g) +ΔQ ,反应CH4的转化率与温度、压强的关系,且p1>p2、0<ΔQ
D.图④中曲线表示反应2SO2(g)+O2(g)  2SO3(g) +ΔQ ,0<ΔQ;正、逆反应的平衡常数K随温度的变化
2SO3(g) +ΔQ ,0<ΔQ;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)乙二胺四乙酸可由乙二胺(H2NCH2CH2NH2)、氰化钠(NaCN)和甲醛水溶液作用制得,能和Fe3+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如下:
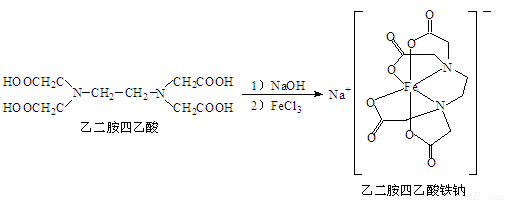
(1)Fe3+基态核外电子排布式为 。
(2)与CN-互为等电子体的一种非极性分子为 (填化学式)。
(3)乙二胺四乙酸中C原子的轨道杂化类型是 ;C、N、O三种元素的第一电离能由大到小的顺序是 。
(4)乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是 。
(5)请在乙二胺四乙酸铁钠结构图中用“箭头”表示出配位键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com