
(14分)硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
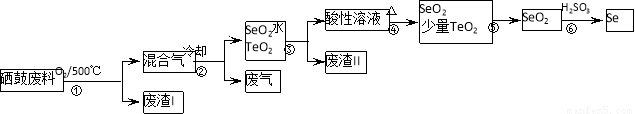
已知:
物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
(1)Se的氢化物的电子式是______。
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。
(14分)
(1)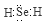
(2)增大接触面积,加快反应速率,使废料充分燃烧
 (3)CO2 TeO2
(3)CO2 TeO2
(4)H2SeO3 SeO2+H2O 2H2SO3 + SeO2=Se+2H2SO4
(5)升华,将温度控制在315℃到450℃之间
【解析】
试题分析:(1)Se是第六主族元素,氢化物的化学式与H2O相似,属于共价化合物,电子式为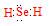 ;
;
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是增大接触面积,加快反应速率,使废料充分燃烧
(3)根据硒鼓废料的成分判断,废气是CO2;SeO2易溶于水,TeO2微溶于水,所以废渣主要是TeO2;
(4)SeO2溶于水生成H2SeO3,受热分解生成SeO2,化学方程式为H2SeO3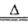 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
(5)根据SeO2和TeO2升华的温度,二者分离的最适宜方法是升华,将温度控制在315℃到450℃之间
考点:考查Se元素的性质,电子式、化学方程式的书写,物质分离方法的判断


科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:选择题
下图所示的实验装置或操作不能达到实验目的的是
|
| |
|
A.配制100 mL 0.1 mol /L盐酸 | B. 验证AgCl和Ag2S的溶解性 | C.测定中和反应 的反应热 | D.实验室制取 并收集氨气 |
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:简答题
(14分)2SO2(g)+O2(g) 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
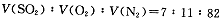 投料,在
投料,在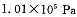 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。

(1)该反应是_ 反应(填“放热”或“吸热”)。
(2)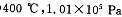 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
(3)硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是 (填序号)。
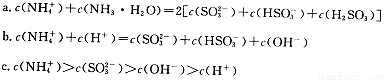
②用MnO2与水的悬浊液吸收上述尾气并生产MnSO4
i.得到MnSO4的化学方程式是
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2的吸收率与溶液pH的关系如图乙。

图甲中pH变化是因为吸收中有部分SO2转化为H2SO4生成H2SO4反应的化学方程式是____;由图乙可知pH的降低 SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:选择题
下图是研究铁钉腐蚀的装置图。下列说法不正确的是

A.ab在两处的腐蚀速率.a<b
B.a、b两处铁钉中的碳均为正极
C.a、b两处铁钉中的铁均失电子被氧化
D.a、b两处的正极反应式均为O2+4e-+ 4 H+=2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:选择题
下图是研究铁钉腐蚀的装置图,下列说法不正确的是
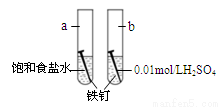
A.铁钉在两处的腐蚀速率:a < b
B. a、b两处铁钉中碳均正极
C. a、b两处铁钉中的铁均失电子被氧化
D. a、b两处的正极反应式均为O2+4e-+4H+ ===2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:填空题
(12分)有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下:
元素编号 | 特征信息 |
A | 其中一种原子核内只有质子没有中子 |
B | 其原子的L层电子数是K层的3倍 |
C | 其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
D | 其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
E | 单质为黄绿色气体,可用于制造漂白粉 |
请回答以下问题:
(1)由A、B、C三种元素形成的化合物含有的化学键类型是 。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程
式 。
(3)D单质与由A、B、C三种元素形成的化合物的水溶液反应的离子方程式
。
(4)写出实验室用软锰矿(MnO2)制取E的化学方程式 。
(5)C和D两元素形成的单质活泼些较强的是 (写元素符号),判断依据是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗下层液体应从下口放出,上层液体应从上口倒出
D.萃取操作时,所选萃取剂溶解溶质能力应大于原溶剂且与原溶剂互不相溶
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:推断题
(12分)我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质。
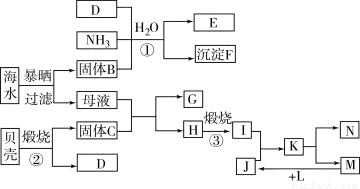
结合上述工艺流程回答下列问题。
(1)物质H和L的化学式分别为 和 。
(2)上述工艺流程中可以循环使用的物质的化学式为____________。
(3)反应①的化学方程式为 ;在反应①中必须先通入NH3,而后通入D,其原因是 。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为 。
(5)由K溶液经如何处理才能制得N?工业上将K溶液在 的条件蒸发结晶制得无水盐,然后再电解其熔融盐,写出电解的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2H4与C4H6 | B.C3H4与C4H8 | C.C3H6与C4H6 | D.C4H8与C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com