
实验室通过简单的“试管实验”,即可探索元素的金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
| 实验方案(只要求填写选用试剂) | ① | ② |
| 填试剂序号 | 填试剂序号 | |
| 实验现象 | 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 | |
| 有关反应的离子方程式 | ||
| 结论 | 金属性:Mg>Al | 非金属性: |
试剂:①镁条、②铝条、③氯水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液
科目:高中化学 来源: 题型:阅读理解
| 无水AlCl3 |
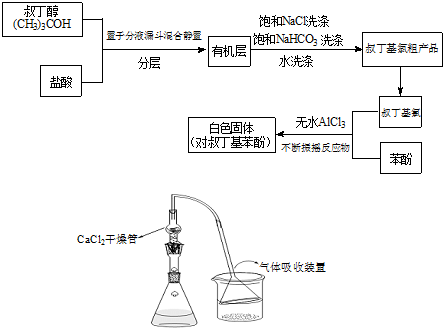
 +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
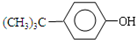 +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
 +HCl
+HCl查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 无水AlCl3 |
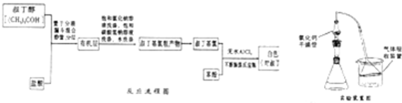
| 实验方案 | 实验现象 | 能否说明水解 |
| ①将锥形瓶中白雾通入HNO3酸化的AgNO3溶液 | ||
| ②将充分冒白雾后的液体抽滤,得不溶性固体,将 固体分成两份 |
两份固体均溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | --- |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | --- |
I.(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金. 理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理: ( 填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,下列试剂中最好的是 (填序号),并说明理由:_____________________________________________________.
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度 越稀,对应还原产物中氮元素的化合价越低。为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
越稀,对应还原产物中氮元素的化合价越低。为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1)逐滴加入4mol/L的氢氧化钠溶液的定量玻璃仪器 图中OC段没有沉淀生成的原因是:__________________________.(用离子方程式表示)
(2)由上述图形分析可知,溶液中结合OH-能力最强的离子是_______(填离子符号,下同)、最弱的离子是 。若测定F点沉淀的质量,需对混合物进行:过滤、 、 、称量。
(3)通过上图数据试计算,熔融物中两种金属的物质的量之比n(Fe):n(Al)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com